
科目: 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第________周期第________族。
(2)E元素形成的氧化物对应的水化物的化学式为____________________。
(3)元素C、D、E形成的简单离子半径大小关系是 ______>______>_____(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:____________________。C、D还可形成化合物D2C2,D2C2中含有的化学键是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业水合肼法制备叠氮化钠的工艺流程如图所示:
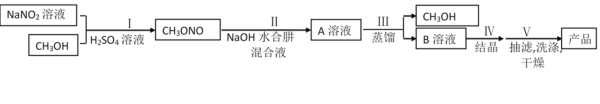
一、合成水合肼
己知:![]() (水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。
(水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。![]() (水合肼)熔点-40℃,沸点118.5℃。
(水合肼)熔点-40℃,沸点118.5℃。
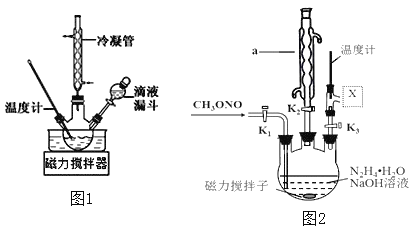
合成![]() 的装置如图1所示。
的装置如图1所示。![]() 碱性溶液与尿素
碱性溶液与尿素![]() 水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
(1)写出![]() 的结构式____________,
的结构式____________,![]() 的电子式____________
的电子式____________
(2)①写出制取![]() 的离子方程式___________________________
的离子方程式___________________________
②实验中通过滴液漏斗滴加的溶液是_________理由是_______________图1使用冷凝管的目的是____________________________________
③从反应后的混合溶分离出![]() ,应该采用的分离方法最合理的是________。
,应该采用的分离方法最合理的是________。
二、合成叠氮化钠(![]() )晶体
)晶体
已知:相关物质的物理性质如下表
熔点℃ | 沸点℃ | 溶解性 | |
| -97 | 67.1 | 与水互溶 |
水合肼( | -40 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯( | -17 | -12 | 溶于乙醇、乙醚 |
NaN3 | 与水互溶,不溶于乙醚、微溶于乙醇 |
(3)实验室模拟工艺流程步骤Ⅱ的实验装置如图2
①根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是________________。(写出1点即可)
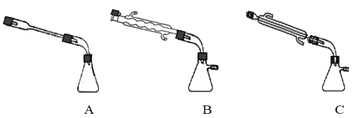
②图中![]() 处连接的最合适装置应为下图中的__________。
处连接的最合适装置应为下图中的__________。
③步骤Ⅱ中制备叠氮化钠的操作是________(填序号)步骤Ⅲ中溶液![]() 进行蒸馏的合理操作顺序是_______。(填序号)
进行蒸馏的合理操作顺序是_______。(填序号)
①打开![]() ,关闭
,关闭![]() ②打开
②打开![]() ③加热 ④关闭
③加热 ④关闭![]()
(4)步骤Ⅳ对溶液![]() 加热蒸发至溶液体积的
加热蒸发至溶液体积的![]() ,
,![]() 结晶析出。步骤Ⅴ可以用________洗涤晶体。
结晶析出。步骤Ⅴ可以用________洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
(5)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
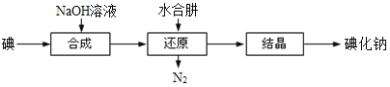
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阳极的电极反应式________;
(3)某课题组用上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净。洗涤沉淀的操作是________。
②反应①的离子方程式为______________________。
③如下图,氧化还原滴定法测定制得的Ce(OH)4产品纯度。
![]()
该产品中Ce(OH)4的质量分数为________________(保留两位有效数字)。若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度__________ (“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】取10.6g Na2CO3溶于水配成100ml溶液,求:
(1)Na2CO3物质的量_______。
(2)Na2CO3溶液的物质的量浓度_______。
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.4mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、火力发电厂释放出大量氮氧化合物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) △H1=-574 kJ/mol
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为__________________________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
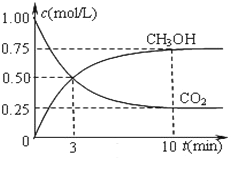
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。回答:0~10 min内,氢气的平均反应速率为___mol/(L·S);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_________(填“正向”、“逆向”或“不”)移动。
Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。
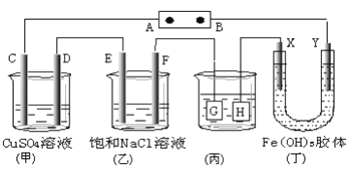
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为_________________________
(2)欲用(丙)装置给铜镀银,银应该是 _____电极(填G或H)
(3)(丁)装置中Y极附近红褐色变_______(填深或浅)
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)在100 mL 0.8mol/L硝酸溶液中加入足量铜粉,则被溶解的铜的质量为_______g。
(2)在上述溶液中再加入足量稀硫酸,又有_______g铜溶解。
Ⅱ. 请回答下列问题:25℃时,浓度均为0.10mol L﹣1的 ①氨水 ②NH4Cl溶液
(1)NH4Cl溶液显_________(酸、碱、中)性,原因是(用离子方程式表示)____________________________________,若加入少量的氨水,使溶液中c(NH4+)=c(Cl﹣),则溶液的pH_____7 (填“>”、“<”或“=”).
(2)氨水显碱性的原因(用离子方程式表示)______________________,向氨水中加入NH4Cl固体,氨水的电离程度________(填“增大”、“减小”或“不变”),溶液的pH将________(填“增大”、“减小”或“不变”).
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某温度下,在2L的密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) ![]() cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
cC(g) △H = —QkJ·mol—1(Q>0)。12s时达到平衡,生成C的物质的量为0.8mol,反应进程如下图所示。
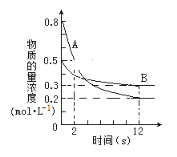
(1)化学计量数b:c=_______
(2)前12s内,A的平均反应速率为________________
(3)12s内,A和B反应放出的热量为__________
Ⅱ.已知:Cu+2FeCl3=2FeCl2+CuCl2利用这一反应,试设计一个原电池,指出电极材料名称,并写出电极反应式
正极:__________ 电极反应:__________________
负极:__________ 电极反应:__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】低碳经济成为一种重要的生活理念,二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向.
(1)以![]() 与
与![]() 为原料合成尿素[化学式为
为原料合成尿素[化学式为![]() 的主要反应如下:
的主要反应如下:
①![]()
![]()
②![]()
![]()
③![]()
![]()
则![]() 与
与![]() 合成尿素和液态水的热化学方程式为____________
合成尿素和液态水的热化学方程式为____________
(2)用![]() 催化加氢还可以制取二甲醚:
催化加氢还可以制取二甲醚:![]()
![]()
某压强下,合成二甲醚的反应在不同温度、不同投料比时,![]() 的平衡转化率如图所示。
的平衡转化率如图所示。

①图中![]() 三点对应的平衡常数分别为
三点对应的平衡常数分别为![]() ,其三者大小的关系是____________.
,其三者大小的关系是____________.
②![]() 温度下,将
温度下,将![]() 和
和![]() 充入
充入![]() 的密闭容器中,经过
的密闭容器中,经过![]() 反应达到平衡,则
反应达到平衡,则![]() 内的平均反应速率
内的平均反应速率![]() _______,平衡常数的数值
_______,平衡常数的数值![]() ___________(列出计算式即可)。
___________(列出计算式即可)。
(3)惰性材料做电极,电解强酸性的二氧化碳水溶液得到可得到多种燃料,其原理如图所示.则电解时,生成丙烯的电极反应式是___________________

(4)以![]() 为原料制取碳黑(
为原料制取碳黑(![]() )的太阳能工艺如图所示。过程2中发生反应的化学方程式为
)的太阳能工艺如图所示。过程2中发生反应的化学方程式为![]() ;则过程1中每消耗
;则过程1中每消耗![]()
![]() 转移电子的物质的量为___________________.
转移电子的物质的量为___________________.

(5)一定量![]() 溶于
溶于![]() 溶液中恰好得到
溶液中恰好得到![]()
![]() 溶液,在常温下用
溶液,在常温下用![]() 的盐酸对其进行滴定,所得滴定曲线如图所示.
的盐酸对其进行滴定,所得滴定曲线如图所示.![]() 点所得溶液中各种离子的物质的量浓度由大到小的排列顺序是______________(
点所得溶液中各种离子的物质的量浓度由大到小的排列顺序是______________(![]() 的电离常数为
的电离常数为![]() 、.
、.![]() .)
.)

查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是
A. 煤经过气化、液化等一系列物理变化可转变为清洁燃料
B. 用植物秸秆造纸并将废水通过高压水井压到地下,可节约能源
C. 食品袋内活性炭粉、活性铁粉和![]() 组成的混合物作除氧剂和干燥剂
组成的混合物作除氧剂和干燥剂
D. 华为手机![]() 外壳上贴的碳纤维膜是一种新型有机高分子材料
外壳上贴的碳纤维膜是一种新型有机高分子材料
查看答案和解析>>
科目: 来源: 题型:
【题目】
化合物E(碘他拉酸)可用于CT检查、动静脉造影等,其一种合成路线如下:

(1)A中含有的含氧官能团为___________:①~④中不属于取代反应的是___________。
(2)C的结构简式为___________;药品中碘他拉酸的含量通常采用测定药品中碘量的方法,则测定碘量需要用到的试剂为______________________。
(3)B有多种同分异构体,满足下列条件的同分异构体的结构简式为___________。
①苯环上有五个取代基 ②lmol能与2 molNaHCO3发生反应
③能发生银镜反应 ④核磁共振氢谱只有4个峰值
(4)已知:①苯胺(![]() )易被氧化
)易被氧化
![]()

请以甲苯和(CH3CO)2O为原料制备 ,写出相应的合成路线流程图___________(无机试剂任选,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图___________(无机试剂任选,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com