
科目: 来源: 题型:
【题目】最新合成的某有机物A的结构简式如图,它含有1个手性碳原子,具有光学活性。若要使A通过反应失去光学活性,则发生的反应类型不可能是( )

A. 酯化反应 B. 水解反应 C. 银镜反应 D. 加成反应
查看答案和解析>>
科目: 来源: 题型:
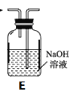
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)

下列关于元素R的判断中一定正确的是( )
A. R的最高正价为+3价
B. R元素位于元素周期表中第ⅡA族
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A. 碘与干冰分别受热变为气体
B. 硝酸铵与硝酸分别受热变为气体
C. 氯化钠与氯化氢分别溶解在水中
D. 晶体钠与冰分别受热熔化
查看答案和解析>>
科目: 来源: 题型:
【题目】a,b,c,d为四种由短周期元素构成的中性粒子,它们都有14个电子,且除a外都是共价型分子。回答下列问题:
(1)a是单核粒子,a单质可用作半导体材料,a原子核外电子排布式为______________。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为________。人一旦吸入b气体后,就易引起中毒,是因为__________而中毒。
(3)c是双核单质,写出其电子式____________。c分子中所含共价键的类型为_______(填“极性键”或“非极性键”)。c单质常温下性质稳定,不易起反应,原因是________________________。
(4)d是四核化合物,其结构式为______________;d分子内所含共价键有________个σ键,________个π键;σ键与π键的强度大小关系为σ___π(填“>”、“<”或“=”),原因是:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数 K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
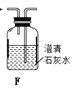
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为__________(填字母序号)。
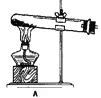

![]()

(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B中发生反应的离子方程式____________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快” __________(选填“能”或“不能”);简述你的理由:_______________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有(___________)(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.02mL。
p>①所用指示剂为__________;滴定终点时的现象为_____________________________________;②H2C2O4溶液物质的量浓度为__________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A.滴定管在盛装NaOH溶液前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列离子晶体立体构型示意图如下图所示。


(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:________,C:________,D:__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 和 (填化学式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4-离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )

A. 图a曲线,a、b、c三点对应的KW依次增大,且可通过增加c(H+)实现转化
B. 图a曲线,b点下的温度,将pH=2的H2SO4与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 图b曲线,用0.010 0 molL1硝酸银滴定浓度均为0.1000 molL1 A-、B-及C-的混合溶液,首先沉淀的是A-
D. 图b曲线,Ksp(AgA)<Ksp(AgB)<Ksp(AgC),故任何条件下AgB沉淀不能转化为AgC
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:

(1)代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com