
科目: 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:
4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为______,基态Mn3+含有的未成对电子数是______。
(2) CH3COOH中碳原子的杂化形式为________。
(3) NO3-的空间构型是________,与NO3-互为等电子体的分子的化学式为__________(任写一种)。
(4) CH3COOH能与H2O以任意比互溶的原因是____________________。
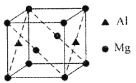
(5)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为_______,晶体中每个镁原子周围距离最近的铝原子数目为_______,该晶体的密度为______g/cm3(阿伏伽德罗常数的数值用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应aA(s)+bB(g)![]() cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
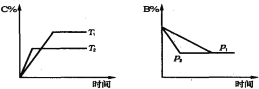
A. T1>T2,正反应放热
B. Tl<T2,正反应吸热
C. P1>P2,a+b>c+d
D. Pl<P2,b=c+d
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A. 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多
B. 由C(石墨)=C(金刚石) ΔH= +11.9 kJ/mol,可知金刚石比石墨稳定
C. 水力(水能)按不同的分类可看成可再生能源和一级能源
D. 表示氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8 kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】将13.0 g锌投入250mL某浓度的盐酸中,锌和盐酸恰好完全反应。求:
(1)反应中生成的H2在标准状况下的体积。__
(2)所用盐酸中HCl的物质的量浓度。_____________
(3)需用多少体积的36.5%的浓盐酸(ρ =1.20 g/mL)来配置上述盐酸。_________
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期中五种元素A,B,C,D,E原子序数依次增大,其中A,B,C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B,C,D,E四种元素的原子,半径从大到小的顺序是__(填元素符号或化学式,下同);第一电离能从大到小的顺序是__
(2)C原子的电子排布图__,D2﹣的结构示意图__.A,D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式__,分子中含有__键(填“极性”或“非极性”,下同)是__分子.
(3)A,B,D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式__,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为__杂化,空间构型为__.
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为__,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为__.
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是世界铅生产和铅消费的最大国,而铅的冶炼方法具有成本高、污染严重等缺点。
I.铅的冶炼
一种用铅矿石(主要成分为PbS)冶炼铅的改进工艺流程如下图所示。

(1)浮选前将铅矿石破碎的目的是____________________
(2)反应器氧化段的主要反应有2PbS+3O2![]() 2PbO+2SO2(反应a)和PbS+2PbO
2PbO+2SO2(反应a)和PbS+2PbO![]() 3Pb+SO2(反应b),反应a中的氧化剂是_______(填化学式);反应b中氧化产物和还原产物的物质的量之比为____________。
3Pb+SO2(反应b),反应a中的氧化剂是_______(填化学式);反应b中氧化产物和还原产物的物质的量之比为____________。
(3)该工艺流程与传统方法相比优点之一就是可得到富SO2烟气,富SO2烟气可直接用于某种工业生产,请写出表示该工业生产的原理的化学方程式_________、________。
Ⅱ.含铅废水处理
化学沉淀法是除去酸性废水中Pb2+的主要方法,根据其原理不同可以分为:氢氧化物沉淀法、硫化物沉淀法、磷酸盐沉淀法、铁氧体沉淀法等。水溶液中各形态铅的百分含量x与溶液pH变化的关系如图所示。向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清。

(4)若采用氢氧化物沉淀法除溶液中的Pb2+,应将溶液的pH调至约为______。pH![]() 13时,溶液中发生的主要反应的离子方程式为________________________。
13时,溶液中发生的主要反应的离子方程式为________________________。
(5)向酸性含铅废水中加Na2S可将Pb2+转化为PbS除去,使用该方法通常先将溶液pH调至6左右,若溶液pH过低会导致_____。已知Ksp (PbS) =8.0![]() 10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0
10-28,国家规定的废水排放标准中铅含量不高于0.5mg/L,若某工厂处理过的废水中S2-浓度为2.0![]() 10-20mol/L,该废水中铅含量_________ (填“已经”或“尚未”)达到国家规定的排放标准。
10-20mol/L,该废水中铅含量_________ (填“已经”或“尚未”)达到国家规定的排放标准。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。请回答下列问题:
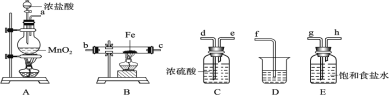
(1)A 中发生反应的化学方程式为________________________。在该反应中当 0.4molHCl发生反应时,生成标准状况下的Cl2 的体积为______。浓盐酸在反应中显示出来的性质是__(填序号);
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)各装置的正确连接顺序为(填写装置代号)A→_____→_____→_____→D。
(3)装置 E 的作用是_______。写出装置 D(D中所盛溶液为 NaOH)中反应的化学方程式_______
(4)工业上用电解法制备氯气的化学方程式为:____________。
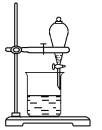
Ⅱ.某小组用CCl4萃取碘水中的碘,在下图的分液漏斗中,下层液体呈__________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为:C3H8(g) ![]() C3H6(g)+H2(g) ΔH。请回答下列相关问题。
C3H6(g)+H2(g) ΔH。请回答下列相关问题。
(1)下表为部分键能数据,据此可算出△H=_________kJ/mol。
化学键 | C—C | C=C | C—H | H—H |
键能(kJ/mol) | 332 | 611 | 414 | 436 |
(2)一定温度下,向2L的密闭容器中充入2molC3H8发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.4倍。
①0~10 min内氢气的生成速率v(H2)=__________,C3H8的平衡转化率为_________。
②下列情况能说明该反应达到平衡状态的是___________。
A.混合气体的平均分子量保持不变
B. C3H6与H2的物质的量之比保持不变
C.混合气体的密度保持不变
D. C3H8的分解速率与C3H6的消耗速率相等
(3)脱氢反应分别在压强为p1和p2时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示。

①压强:p1______p2(填“>”或“<”)。
②为了同时提高反应速率和反应物的平衡转化率,可采取的措施是__________。
③若p1=0.1 MPa,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数Kp_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
④在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始n(氩气)/n(丙烷)越大,丙烷的平衡转化率越大,其原因是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3会快速分解为FeBr2。某化学小组同学用下图所示装置制备溴化亚铁,请回答相关问题:
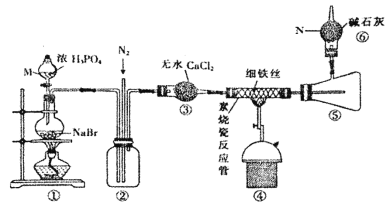
(1)仪器M、N的名称依次是________、________。
(2)装置⑥的作用是____________,从装置末端排出的气体是否需要处理________(填“是”或“否”)
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是__________。
(4)将浓磷酸换成浓硫酸同样能制得HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制HBr的原因是硫酸和磷酸都具备某种性质,该性质是________。
②溶液变橙黄色是因为发生了副反应___________(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度_____ (填“有”或“没有”)影响,理由是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三种常见元素结构信息如下表,试根据信息回答有关问题:

(1)写出B原子的基态电子排布式__;
(2)用氢键表示式写出A的氢化物溶液中存在的氢键__(任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角__(填写“变大”、“变小”、“不变”);
(3)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__,简要描述该配合物中化学键的成键情况__;
(4)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“”表示没有形成共价键的最外层电子,短线表示共价键.

在以上分子中,中心原子采用sp3杂化形成化学键是__(填写序号);在②的分子中有__个σ键和__个π键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com