
科目: 来源: 题型:
【题目】在恒温恒容中反应:2NO2(g)![]() 2NO(g)+O2(g),能说明反应达平衡状态的是:
2NO(g)+O2(g),能说明反应达平衡状态的是:
①单位时间内生成n mol O2的同时生成2n mol NO2;
②单位时间内生成n mol O2 的同时生成2n mol NO;
③NO2、NO、O2 的反应速率的比为2 : 2 : 1的状态;
④混合气体的颜色不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
A. ①④⑥ B. ②③⑤ C. ①③④ D. 全部
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
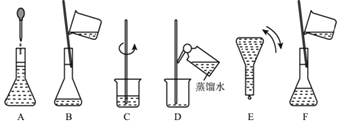
(1)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是_____。
①干燥的 ②瓶塞不漏水的 ③用欲配制的溶液润洗过的 ④以上三项均须要求的
(2)若用Na2CO310H2O来配制溶液,需要称量晶体_____克。若所称取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)
(3)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(4)步骤B通常称为转移,步骤A通常称为_____。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(5)将上述实验步骤A﹣F按实验过程先后次序排列_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极上通乙烷和氧气,其电极反应式为:C2H6+18OH--14e- =2CO32-+12H2O,7H2O+![]() O2+14e- =14OH-,有关此电池的推断正确的是
O2+14e- =14OH-,有关此电池的推断正确的是
A. 电解质溶液中电子向正极移动
B. 放电一段时间后,KOH的物质的量浓度不变
C. 通乙烷的电极为负极
D. 参加反应的O2和C2H6的物质的量之比为2:7
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请回答下列问题:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________(填标号)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是___________________。
在分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:________
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg–AgCl电池是一种以海水为电解质溶液的水激活电池。如图用该水激活电池为电源电解NaCl溶液的实验中,X电极上有无色气体逸出。下列有关分析正确的是

A. II为正极,其反应式为Ag+ + e– =Ag
B. 水激活电池内Cl–由正极向负极迁移
C. 每转移1 mole-,U型管中消耗0. 5mol H2O
D. 开始时U型管中Y极附近pH逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 苯和液溴在光照条件下生成溴苯
B. C4H2Cl8有8种同分异构体(不含立体异构)
C. 以淀粉为原料可制取乙酸乙酯
D. 木材纤维和土豆淀粉遇碘水均显蓝色
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2![]() I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,利用SRB(硫酸盐还原菌)治理废水中的有机物、SO42-及重金属污染取得了新的进展。
(1)下图表示H2CO3和H2S在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样pH=8.5,在SRB的作用下,废水中的有机物(主要为CH3COO─)将SO42-还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:_______________。
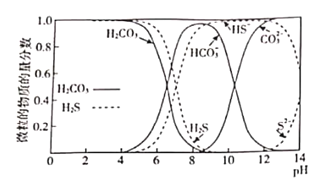
(2)SRB除去废水中有机物的同时,生成的H2S还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如下图所示。

①写出电池正极的电极反应:________________。
②负极室的pH随反应进行发生的变化:__________(“减小”或“增大”),结合电极反应解释pH变化的原因:__________。
(3)SRB可用于处理废水中含重金属锑(Sb)的离子。
①通过两步反应将Sb(OH)6-转化为Sb2S3除去,转化过程中有单质生成。完成第一步反应的离子方程式。
第一步: Sb(OH)6-+ H2S ===1 + 1 ↓+ H2O,_______________________
第二步:3H2S +2SbO2-+2H+ ===Sb2S3↓ +4H2O
②某小组模拟实验时配制amL含Sb元素b mg·L-1 的废水,需称取________gKSb(OH)6(相对分子质量为263)。提示:列出计算式即可。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阳极逸出a mol气体,同时析出w克Na2SO4·10H2O晶体,若温度不变,此时剩余溶液的质量分数是
A. ![]() ×100% B.
×100% B. ![]() ×100%
×100%
C. ![]() ×100% D.
×100% D. ![]() ×100%
×100%
查看答案和解析>>
科目: 来源: 题型:
【题目】金是一种用途广泛的贵重金属。某化工厂利用氰化法从一种含金矿石中提取金的工艺流程如下:
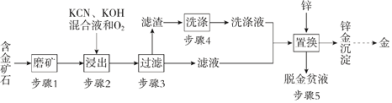
资料:
① Zn + ![]() O2 + H2O = Zn(OH)2
O2 + H2O = Zn(OH)2
② Zn2+(aq) ![]() Zn(CN)2(s)
Zn(CN)2(s) ![]() Zn(CN)42-(aq)
Zn(CN)42-(aq)
(1)步骤2中发生的反应有:
① 2Au(s) + 4CN-(aq) + 2H2O(l) + O2(g) = 2Au(CN)2-(aq) + 2OH-(aq) + H2O2(aq) H = -197.61 kJ·mol-1
② 2Au(s) + 4CN-(aq)+ H2O2(aq) = 2Au(CN)2-(aq) + 2OH-(aq) H = -386.93 kJ·mol-1
则2Au(s)+ 4CN-(aq)+ H2O(l) + 1/2O2(g) = 2Au(CN)2-(aq) + 2OH-(aq)的H =_______。
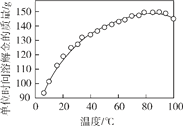
(2)下图是步骤2中金的溶解速率与温度的关系。80℃以后溶解速率降低的原因是___________。
(3)步骤4的目的是_________________。
(4)步骤5置换的总反应是:
2Au(CN)2- + 3Zn + 4CN- + 2H2O = 2Au + 2Zn(CN)42- + ZnO22- + 2H2↑
则以下说法正确的是________(填字母序号)。
A 步骤5进行时要先脱氧,否则会增加锌的用量
B 若溶液中c(CN-)过小,会生成Zn(CN)2,减缓置换速率
C 实际生产中加入适量Pb(NO3)2的目的是形成原电池加快置换速率
(5)脱金贫液(主要含有CN-)会破坏环境,影响人类健康,可通过化学方法转化为无毒废水净化排放。碱性条件下,用Cl2将贫液中的CN-氧化成无毒的CO2和N2,该反应的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com