
科目: 来源: 题型:
【题目】实验室用下列两种方法制取氯气:①用含HCl 146g的浓盐酸与足量的MnO2反应;②用87g MnO2与足量的浓盐酸反应,则所得Cl2质量
A. ①比②多B. ②比①多C. 一样多D. 无法比较
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中发生反应:2A(g)+B(g)![]() 2C(g) ΔH ,图1表示该反应在不同温度下B的转化率随温度变化曲线,图2表示该反应的反应速率(v)随时间(t)变化图像。
2C(g) ΔH ,图1表示该反应在不同温度下B的转化率随温度变化曲线,图2表示该反应的反应速率(v)随时间(t)变化图像。

请回答下列问题:
(1)图中a、b、c三点的化学反应速率(v)由快到慢是__________。
(2)图中该反应的ΔH_______0。
(3)图中a、b、c三点,未达到平衡状态且v正>v逆的点是_______。

请回答下列问题:
(4)图中t2时刻改变的外界条件是___________。
(5)图中从t1 ~ t6 反应物转化率最低的是_______时刻。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8gNH4+离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为NA
D.5.6g金属铁与足量氯气充分反应时失去的电子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是
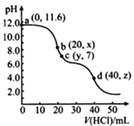
A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的Ka2数量级约为10-6
B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-)
C. a、c两点水的c(OH-)之比为10-11.6 :10-7
D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)欲将0.10 mol.L-1的NaOH溶液和0.60 mol.L-1的NaOH溶液混合成0.20 mol.L-1的NaOH溶液(忽略混合时溶液体积变化),则两种溶液的体积比为___________。
(2)某温度下,40g质量分数为10%硝酸钠溶液与60g质量分数为7.5%的硝酸钠溶液混合,得到密度为1.20 g.cm-3的混合溶液,则该混合溶液中NaNO3的物质的量浓度为______。
(3)现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL二氧化碳气体(在标准状况下)。则原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是_____、____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置。
A  B
B  C
C  D
D 
利用以上装置,可以按以下实验方案从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。(已知甲苯和甲醇均为有机溶剂,有机物大多能互溶)

(1)装置A中仪器①的作用是_____,流程中使用装置A的是操作___(填“a”、“b”、“c”或“d”,下同)。
(2)流程中使用装置B的是操作____,在该操作中,震荡仪器时,为了避免因液体挥发而导致内部气压过大,还应进行的具体操作是______(填写具体的操作方法)。
(3)流程中使用装置C的操作是___,若所得沉淀不溶于水且需要洗涤,则洗涤的具体操作是_____。
(4)流程中使用装置D的操作是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:Ksp[Fe(OH)3]=4.0×1038,Ksp[Cu(OH)2]=2.2×1020

(1)“滤渣1”的主要成分是_______(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②_______(填一种)。
(2)“氧化”过程中,发生氧化还原反应的离子方程式是_______。
(3)“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是_______。
(4)加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×1014mol/L,此时溶液中c(Cu2+)的取值范围是_______mol/L。
(5)加入适量锌粉的作用是_______。
(6)由滤液得到ZnSO47H2O的操作依次为_______、_______、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、_______、_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为人工肾脏采用间接电化学方法除去代谢产物中的尿素(CO(NH2)2)的原理。请回答下列问题:

(1)电源的负极为____(选填“A”或“B”)。
(2)阳极室中发生的反应依次为________________、_________________________。
(3)电解结束后,阴极室溶液的pH与电解前相比将___(选填“降低”、“增大”或“不变”)。
(4)若两极共收集到标准状况下气体6.72 L,则除去的尿素为__g(忽略气体的溶解)。
查看答案和解析>>
科目: 来源: 题型:
【题目】请完成下列问题:
(1)Cl2和水蒸气通过灼热的炭层生成HCl和CO2,当有1 mol Cl2参与反应时释放145 kJ热量。写出该反应的热化学方程式____________________________。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+1/2O2(g) =CO2(g)+2H2O(g) ΔH=-a kJ·mol-1,则a_______238.6(选填“>”、“<”或“=”)。
(3)已知:As(s)+3/2H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+1/2O2(g)=H2O(l) ΔH2
2As(s)+5/2O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)已知在一定温度下:
C(s)+ CO2(g)![]() 2CO(g) 平衡常数K1
2CO(g) 平衡常数K1
C(s)+ H2O(g)![]() CO(g)+ H2(g) 平衡常数 K2
CO(g)+ H2(g) 平衡常数 K2
CO(g)+ H2O(g)![]() H2(g)+ CO2(g)平衡常数K3
H2(g)+ CO2(g)平衡常数K3
则K1、K2、K3之间的关系是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com