
科目: 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】SO2、Na2S2O3、Na2S、Na2SO3、Na2SO4等含硫化合物在工业上有广泛的用途。完成下列填空:
(1)硫原子最外层电子排布式_______________,钠原子的核外有______种能量不同的电子。Na2S的电子式____________。
(2)涉及元素形成简单离子半径大小顺序:__________________;请用原子结构知识说明氧与硫的非金属性强弱________________________________________________________。
(3)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:
____S2O32-+____Cl2+____H2O→____SO42-+____Cl-+____H+,配平该反应方程式:若反应中生成2molSO42-,则转移电子_____mol。
(4)Na2S又称臭碱,用离子方程式说明Na2S溶液呈碱性的原因________。 SO2分子构型“V”形,则SO2是_____(选填“极性”、“非极性”)分子。列举一个实验事实说明SO2具有还原性_________。
(5)图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是____________(填微粒符号)。上述5种物质中,不能促进也不能抑制水电离的化合物____________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是( )

A. 根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子
B. Mr(甲)=Mr(乙)+Mr(丙)
C. 该反应一定属于氧化还原反应
D. 该反应类型是分解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在容积不变的密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)+Q(Q>0),图曲线a表示该反应过程中NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )
N2(g)+2CO2(g)+Q(Q>0),图曲线a表示该反应过程中NO的转化率与反应时间的关系。若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )

A. 降低温度B. 加催化剂
C. 增大反应物中NO的浓度D. 向密闭容器中加入氩气
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是

A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目: 来源: 题型:
【题目】TiC14是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

已知:①PdC12溶液捕获CO时,生成金属单质和两种酸性气体化合物。
②

请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为a→____→____→f→g→___→____→_____→_____→_____(填仪器接口字母)。
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;_____________(按正确的顺序填入下列操作的序号)。
①关闭分液漏斗活塞 ②打开分液漏斗活塞
③停止加热,充分冷却 ④加热装置D中陶瓷管
(3)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为________。
(4)设计实验证明装置E中收集到的液体中含有TiCl4:__________________________。
(5)装置F中发生反应的化学方程式为_____________。用其他方法也可代替装置F,可以是______(写出一种即可)。
(6)制得的TiC14产品中常含有少量CC14,从产品中分离出TiC14的操作名称为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
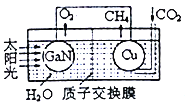
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应能量的说法正确的是( )
A. 一定条件下2SO2(g)+O2(g) ![]() 2SO3(g) △H1 ,2SO2(g)+O2(g)
2SO3(g) △H1 ,2SO2(g)+O2(g) ![]() 2SO3(l) △H2 则△H1>△H2
2SO3(l) △H2 则△H1>△H2
B. 相同条件下,如果1 mol 氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2
C. 甲烷的燃烧热为890.3 kJmol﹣1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=﹣890.3 kJmol﹣1
D. 已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合放出57.3 kJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】将同温同压下的H2、O2、Cl2按13:6:1的体积比混合,在密闭容器中用电火花引燃,充分反应后使产物冷却液化,所得溶液的质量分数是( )
A.33.6%B.25.3%C.16.8%D.14.5%
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:

(1)从 a口通入的气体为_______。
(2)B电极的电极材料是________。
(3)写出甲中通甲烷一极的电极反应式:________________________________ 。
(4)写出乙中发生的总反应的离子方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com