
科目: 来源: 题型:
【题目】现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,如图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁α-Fe2O3)的生产流程示意图,下列说法错误的是( )
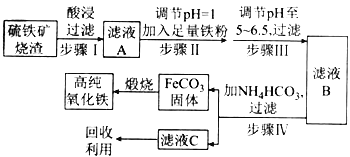
A. 步骤I中过滤所得滤渣的主要成分是SiO2
B. 步擦Ⅱ中加入铁粉的目的是将Fe3+还原为Fe2+
C. 步骤Ⅲ中可选用稀硝酸调节溶液的pH
D. 从滤液C中回收的主要物质可作氮肥
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. CH3CH2CH(CH3)CH3的名称为3一甲基丁烷
B. CH3CH2CH2CH2CH3和CH3CH2CH(CH3)CH3互为同素异形体
C. ![]() 和
和![]() 为同一物质
为同一物质
D. CH3CH2OH和CH2OHCHOHCH2OH具有相同的官能团,互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,VmL不饱和NaNO3溶液ag,蒸发掉bg水或加入bg NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是( )
A. 该温度下NaNO3的溶解度为100 g
B. 原不饱和溶液中NaNO3质量分数为![]() %
%
C. 原不饱和溶液中NaNO3物质的量浓度为![]() mol·L-1
mol·L-1
D. 原不饱和溶液的密度为![]() g·mL-1
g·mL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,将22.4LHCl溶于足量水中,溶液中含有的HCl分子数为NA
B. 常温常压下,16g14CH4所含中子数目为8NA
C. 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D. 标准状况下,22.4L空气含有NA个单质分子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.CaO+H2O=Ca(OH)2
C.2CO+O2![]() 2CO2D.CaCO3
2CO2D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物J属于大位阻醚系列中的一种物质,在有机化工领域具有十分重要的价值.2018年我国首次使用α-溴代羰基化合物合成大位阻醚J,其合成路线如下:

已知:
回答下列问题:
(1)A 的名称___________________.
(2)C →D的化学方程式_________________________.E →F的反应类型____
(3)H 中含有的官能团________________.J的分子式_______________.
(4)化合物X是D的同分异构体,其中能与氢氧化钠溶液反应的X有_____________种(不考虑立体异构),写出其中核磁共振氢谱有3组峰,峰面积之比为1∶1∶6的结构简式为___________________________.
(5)参照题中合成路线图。涉及以甲苯和 为原料来合成另一种大位阻醚
为原料来合成另一种大位阻醚 的合成路线:__________________。
的合成路线:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成.丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉.羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3 的空间构型为:_______;与SCN- 互为等电子体的分子有:__________________(填分子式)
(5)“NiO”晶胞如图:
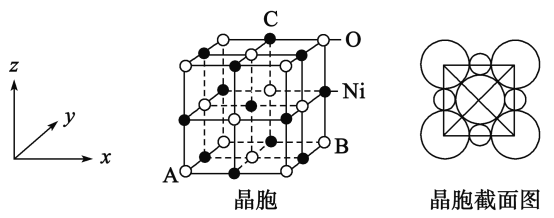
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用氢气合成氨气的原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)用太阳能分解水制备H2是一项新技术,其过程如下
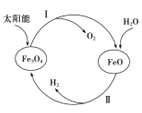
已知:2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ·mol-1 2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.8kJ·mol-1
①过程Ⅱ的热化学方程式是____________________________________.
②整个过程中,Fe3O4 的作用是________________________.
(2)在2L密闭容器中通入3molH2和1molN2,测得不同温度下,NH3的产率随时间变化如图所示.

①下列有关说法正确的是_______________________
A 由b点到c点混合气体密度逐渐增大
B 达到平衡时,2v正(H2)=3v逆(NH3)
C 平衡时,通入氩气平衡正向移动
D 平衡常数,ka<kb=kc
②T1 温度时,0-15min内v(H2)=___________ mol·L-1·min-1.
③已知:瞬时速率表达式v正=k正c3(H2)c(N2),v逆=k逆c2(NH3)(k 为速率常数,只与温度有关).温度由T1 调到T2,活化分子百分率 ______________(填“增大”“减小”或“不变”),k正增大倍数______________k逆增大倍数(填“大于”“小于”或“等于”).T1℃时,k正/k逆=__________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法中正确的是
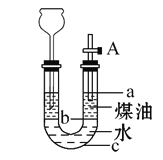
A.打开右端软塞,将一小块金属钠加入煤油中,反应前片刻,钠的位置在a处
B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升进入长颈漏斗,b处有无色气体产生
D.若用苯或酒精来代替煤油,可观察到相同的实验现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com