
科目: 来源: 题型:
【题目】有机物J是一种防止血管中血栓形成与发展的药物,其合成路线如图所示(部分反应条件略去)。

请回答下列问题:
(1)B的名称为______________,反应⑥的反应类型是__________。
(2)J含有_______种官能团。F的结构简式是_____________。
(3)反应③的化学方程式为____________________________________________-。
(4)写出同时满足下列条件的F的同分异构体的结构简式:______________(至少写两种)。
①苯环上只有两个处于对位的取代基;
②1 mol该有机物能与含2 mol NaOH的溶液恰好完全反应。
(5)参照D的合成路线,设计一种以![]() 为原料制备
为原料制备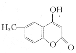 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年9月26日,第五届硒博会在恩施州文化中心大剧院开幕。第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) ![]() 2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2 (g)+O2(g![]() 2H2O(l) △H=b kJ·mol—1
2H2O(l) △H=b kJ·mol—1
反应H2(g)+ Se(s) ![]() H2Se(g)的反应热△H=______kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的反应热△H=______kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2 (g)+Se(s)![]() H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是_______(填字母代号)。
a. 气体的密度不变 b. v(H2) =v(H2Se)
c. 气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:________________________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
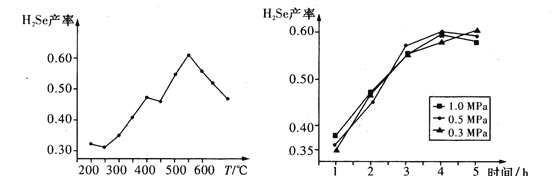
则制备H2Se的最佳温度和压强为________。
(3)已知常温下H2Se的电离平衡常数![]() ,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________,最后通入SO2析出硒单质。
(5) H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9![]() ,CuS的
,CuS的![]() ,则反应CuS(s)+Se2-(aq)
,则反应CuS(s)+Se2-(aq)![]() CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。

(1)用离子方程式解释AgNO3溶液pH<7的原因是____________________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为Ag+和SO42—(Ag2SO4可溶于硝酸);
ii. Ag2O能溶解在浓氨水中形成银氨溶液[Ag(NH2)2OH],而Ag2S和Ag均不能。
①设计并实施如下实验,证实沉淀中含有Ag2S,试剂1和试剂2分别是_________、________。

现象1中出现的现象是_______________________________。
②设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作补充完整。
实验操作 | 实验现象 | |
步骤i | 其少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀, ____________ | 没有沉淀出现 |
写出步骤i中反应的化学方程式:_________________________。
③经检验,沉淀中不含有Ag。
(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如图所示),测得电压为a (a>0)。对AgNO3溶液中氧化S2—的物质进行推测:
假设1:0. 1 mol/L AgNO3溶液(pH=4)中的Ag+氧化了S2—;
假设2:0. 1 mol/L AgNO3溶液(pH=4)中的NO3—氧化了S2—
利用下图装置继续研究(已知:电压大小反映了物质氧化性与还原性强弱的差异;物质氧化性与还原性强弱的差异越大,电压越大)。

①将pH=4的0. 1 mol/L AgNO3溶液替换为_____溶液,记录电压为b(b>0)
②上述实验证实了氧化S2—的物质中一定包含了Ag+,其证据是_________实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】向xmL 0. 1 mol/L氨水中滴加等物质的量浓度的稀H2SO4 ,测得混合溶液的温度和pOH[pOH==-lg c(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化)。下列说法不正确的是
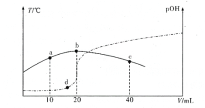
A. x=40
B. a, b,c三点由水电离出的c(H+)依次减小
C. b点时溶液的pOH>pH
D. a,b.d三点对应的NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:
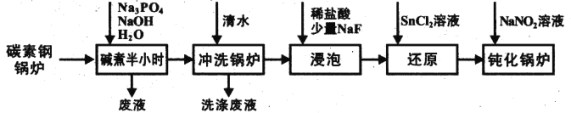
已知:20℃时几种难溶物的溶度积常数如下表(单位省略):
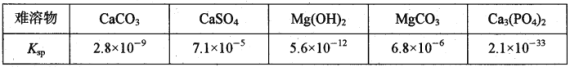
回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________(填现象),则保护膜致密性欠佳。
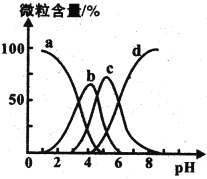
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________。
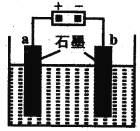
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学利用如图所示的实验装置进行铁与水蒸气的实验,并研究铁及其化合物的部分性质。

请回答下列问题:
(1)硬质试管中发生反应的化学方程式为______________________。
(2)该同学为确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色,则说明硬质试管的固体物质中一定有___,可能有___;若溶液未变红色,则说明硬质试管中固体物质的成分是___________。
(3)该同学按(2)中所述实验方案进行了实验,结果溶液未变红色,原因是________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其与NaOH溶液反应。若按图所示操作,可观察到试管中先生成白色沉淀,后沉淀迅速变成灰绿色,最后变成红褐色的现象,请写出白色沉淀变为红褐色的过程中所发生反应的化学方程式:_________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有_____性。由此可知,实验室中含有Fe2+的盐溶液需现用现配制的原因是______,并且配制含Fe2+的盐溶液时应加入少量_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】
I.如图所示为晶体A的结构,已知晶体A仅由一种元素X组成。X的一种单质可由金属镁与XY2气体加热反应获得。请回答下列问题:
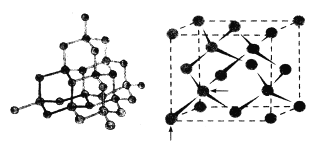
(1)晶体A的名称为__________。
(2)晶体A中X原子的杂化方式为________。
(3)每个A原子参与形成______个6元环。
(4)将每个X原子视为一个球,若X原子的半径为R,1个晶胞中X原子的总体积为V,设一个晶胞的体积为V0,定义堆体积系数α=![]() ,则该晶体的堆积系数α=_____(保留1位有效数字,取
,则该晶体的堆积系数α=_____(保留1位有效数字,取![]() ,π≈3)
,π≈3)
(提示:图中箭头标记的两个原子是相切的,两个原子球心分别位于立方体晶胞顶点和立方体晶胞体对角线四等分点)
II.由分子光谱测得的断裂1个化学键所需的能量称为光谱解离能(D0),1个化学键包含的原子相互作用能称为平衡解离能(D1),两者的关系为![]()
实验测得X-X键振动频率γ=2×1014Hz;
普朗克常数h=6×10-34J·s
阿伏伽德罗常数NA=6×1023mol-1
X为光谱常数。平衡解离能的计算式为![]() ;
;
由实验测得D1=6×10-19J;
用阿伏加德罗常数NA乘D0得到断裂1mol化学键所需的能量E,E称为键能:E=NAD0。
请回答下列问题:
(1)X-X键的键能为______kJ/mol。
(2)1mol晶体A中有_____molX-X键。
(3)原子化热的定义为:断裂lmol晶体中所有化学键需要吸收的热量。原子晶体的原子化热类似于离子晶体的晶格能,那么晶体A的原子化热为______kJ/mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为由石油制取汽油的装置示意图,根据图示回答下列问题。
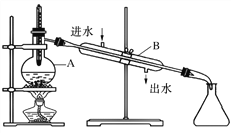
(1)图中的两处明显的错误是________________、__________________
(2)A仪器的名称是________,B仪器的名称是________。
(3)实验时 A 中除加入石油外,还需加入少量__________,其作用是__________________。
(4)收集完汽油后,是先撤酒精灯还是先停冷凝水?
______________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com