
科目: 来源: 题型:
【题目】对羟基扁桃酸是农药、药物、香料合成的重要中间体,它可由苯酚和乙醛酸在一定条件下反应制得:

下列说法不正确的是
A. 上述反应的原子利用率可达到100%
B. 在核磁共振氢谱中对羟基扁桃酸应该有6个吸收峰
C. 1mol对羟基扁桃酸与足量NaOH溶液反应,消耗3 mol NaOH
D. 可以用FeCl3溶液鉴别乙醛酸和苯酚
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验可以实现的是

A. 装置①可检验溴乙烷发生消去反应得到的气体为乙烯
B. 装置②中的CuSO4溶液可用于除去杂质
C. 装置③a处有红色物质生成,b处变蓝,证明X一定是H2
D. 装置④可用于实验室制取乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作正确的是
A. 制乙酸乙酯时,将乙醇注入浓硫酸中,冷却后加入乙酸
B. 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
C. 用氢氧化钠溶液清洗盛过苯酚的试管
D. 在试管中加入2mL2%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 1 mol羟基中所含电子的数目为7NA
B. 28 g乙烯所含共用电子对的数目为4NA
C. 标准状况下,11.2 L二氯甲烷所含的分子数为0.5NA
D. 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型动力电池( LiFePO4电池)总反应式为Li1-xFePO4+LixC6![]() C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是
C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是

A. 电池放电时,LixC6在负极发生氧化反应
B. 电池放电时,正极反应式为 Lil-xFePO4+xLi-+xe-= LiFePO4
C. 电解时,图2的b电极反应式为2H2O-4e-=O2↑+4H+
D. 电解时,当转移0.2mol电子,A口产生气体的质量1.6g
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i. ![]()
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1) A的名称是_______________;C的官能团的名称是_______________。
(2) B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_______________。
(3) E分子中含有两个酯基,且为顺式结构,E的结构简式为_______________。
(4)反应①的化学方程式为_______________________。
(5)试剂a的结构简式为_______________;反应②所属的反应类型为____________反应。
(6)已知Q为G的同分异构体,同时满足下列条件Q的个数为_______(不考虑立体异构)。
①1 mol Q可与足量的NaHCO3溶液反应生成1 mol CO2
②能发生银镜反应
③苯环上有三条支链
(7)已知氨基(-NH2)与-OH类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJmol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJmol-1
①该反应逆反应速率表达式为:v逆=kc(CO) c3(H2),k 为速率常数,在某温度下测得实验数据如表:
CO浓度(molL-1) | H2浓度(molL-1) | 逆反应速率(molL-1min-1) |
0.05 | c1 | 4.8 |
c2 | c1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3mol-3min-1。

②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
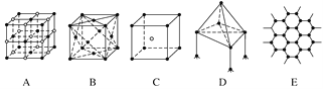
(1)其中代表金刚石的是(填编号字母,下同)____,其中每个碳原子与______个碳原子最接近且距离相等。金刚石属于________晶体。
(2)其中代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(3)代表干冰的是________,它属于________晶体,每个CO2分子与______个CO2分子紧邻。
查看答案和解析>>
科目: 来源: 题型:
【题目】菱锰矿的主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素。氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①相关金属离子[c0(Mn+)=0.1 mol/L]形成氢氧化物沉淀的pH范围如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
②常温下,CaF2、MgF2的溶度积常数分别为1.46×10-10、 7.42×10-11
回答下列问题:
(1) “焙烧”时发生的主要反应的化学方程式为__________。气体X为________(填化学式),写出它生活中的一种用途_______________。
(2)焙烧时温度对锰浸出率的影响如图所示。焙烧时适应温度为_______________。

(3)浸出液“净化除杂”过程如下:首先用MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变成沉淀除去,溶液的pH的范围为____然后加入NH4F将Ca2+、Mg2+转化为CaF2、MgF2沉淀除去,两种沉淀共存时,溶液中![]() =________(所得结果保留两位小数)。
=________(所得结果保留两位小数)。
(4)碳化结晶的原理(用离子方程式表示): ______________________。
(5)将制得的高纯度碳酸锰溶于过量稀硫酸后用惰性电极电解,在某极得到重要的无机功能材料MnO2,该电极的电极反应式为_________。
(6)在该工艺流程中可以循环使用的物质有__________。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com