
科目: 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度 2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。填写下列空白:
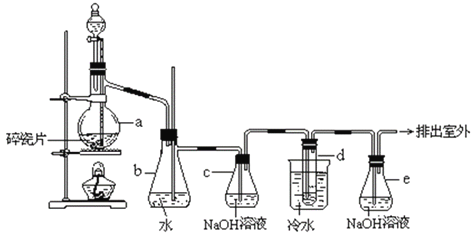
(1) 写出本题中由乙醇制备1,2-二溴乙烷的两个化学反应方程式:
①____________________________________________,反应类型为________________。
②____________________________________________,反应类型为________________。
(2)装置b可以充当安全瓶,防止倒吸,例如:若装置a、b上方气体压强减小,则装置b中的现象为________________________________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________;若无c装置,则d中发生副反应的离子方程式为________________________________________。
(4)在做此实验时,应使a装置中的液体温度迅速升高到所需温度,请用化学方程式表示其原因_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Al、Cl、Cr、Ni等及其相关化合物用途非常广泛。回答下列问题:
(1)基态铬原子的价电子排布式为______。
(2)与硅原子未成对电子数相同的第四周期元素共有______种;钠与铝处于同周期,铝的熔沸点及硬度均比钠大,其原因是______。
(3)KAlO2在水溶液中实际上都是以K[Al(OH)4]形式存在。其中[Al(OH)4]-配离子,中心原子的杂化类型是____。该K[Al(OH)4]物质中存在的化学键有配位健、_____(填字母代号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.氢键
(4)CN2称为氰气,其性质与卤素单质相似。与氢氧化钠溶液反应产物之一为NaCN,写出两种与CN-互为等电子体的分子_____,N元素及与其同周期相邻的两种元素第一电离能由大到小的顺序为______。(填元素符号)
(5)氯化铯熔点:645℃,沸点:1290℃;氯化铝熔点:190℃,在180℃时开始升华,造成二者熔、沸点相差较大的原因是______;下图为氯化铯晶胞,已知氯离子半径为anm,铯离子半径为bnm,则氯化铯晶体密度为_____g·cm-3(用a、b和阿伏加德罗常数NA的代数式表式,列出算式即可)

查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H可用于制备树脂、塑料和涂料等。其合成路线如下图所示:

已知:R—CH=CH2![]() RCH2CH2OH(其中B2H6为乙硼烷)
RCH2CH2OH(其中B2H6为乙硼烷)
请回答下列问题:
(1) 11.2 L(标准状况)的烃A在氧气中充分燃烧可以生成88 g CO2和45 g H2O。A的分子式是____________________。
(2)B和C在氢氧化钠的醇溶液中加热得到的有机物只有一种结构。B和C均为一氯代烃,它们的名称(系统命名)分别为_____________、_____________。
(3)在催化剂存在下1 mol F与2 mol H2反应,生成2甲基1丙醇。F的结构简式是_________________。其含有的官能团名称是_______________________。
(4)B→D,C→D的反应类型均为___________。请任写一个化学方程式_________________。
(5)写出F→G的化学方程式______________________________________________。
(6)写出E+G→H的化学方程式___________________________________________。
(7)写出与G具有相同官能团的G的所有同分异构体的结构简式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”。目前人们对环境保护、新能源开发很重视,研究NO2、NO、CO、SO2等大气污染物转化为能参与大气循环的物质,对建设美丽中国具有重要意义。
(1)有人设计通过硫循环完成CO的综合处理,原理为
a.2CO(g)+SO2(g)![]() S(l)+2CO2(g) △H1=37.4kJ·mol-1
S(l)+2CO2(g) △H1=37.4kJ·mol-1
b.S(l)+2H2O(g)![]() 2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
2H2(g)+SO2(g) △H2=-45.4 kJ·mol-1
则CO和水蒸气完全反应生成H2和CO2的热化学方程式为______。
(2)CO可在一定条件下转化为CH3OH。已知:向2L密闭容器中通入2 molCO和4molH2,在适合的催化剂和T1温度下,发生反应CO(g)+2H2(g)![]() CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
CH3OH(g) △H<0,10min时达到平衡状态,10min后改变温度为T2,20min时达到平衡状态,反应过程中部分数据见表:
反应时间 | CO(mol) | H2(mol) | CH3OH(mol) |
0min | 2 | 4 | 0 |
10min | 2 | ||
20min | 0.2 |
①前10min内的平均反应速率v(CO)=______;在20min时,温度T2下,该反应的化学平衡常数为_______。
②若30min时升高温度,化学平衡常数值_______(填:“增大“减小”“不变”)。
③在T1温度下,既能增大反应速率和提高CO平衡转化率的措施有_______(填两种措施即可)
④在恒温恒容下,下列可以判断CO(g)+2H2(g)![]() CH3OH(g)反应达到平衡状态的_____(填序号)。
CH3OH(g)反应达到平衡状态的_____(填序号)。
a.2v正(H2)=v逆(CH3OH)
b.混合气体的物质的量不再变化
c.单位时间内有1 mol CO消耗同时消耗2molH2
d.混合气体的平均相对分子质量不变
(3)已知反应2NO(g)+O2(g)![]() 2NO2的正反应速率v正=k1Cm(NO)Cn(O2
2NO2的正反应速率v正=k1Cm(NO)Cn(O2

则k1=____,m=_____,n=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据以下物质填空:
①![]() ②
②![]() ③
③![]() ④
④![]()
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧ ⑨
⑨
⑩
(1)上述有机物中能与金属钠反应的是________(填序号,下同),能与碳酸氢钠反应的是________,能与碳酸钠反应的是____________。
(2)上述有机物中属于同分异构体的是_____________(填序号,下同),属于同系物的是______________,属于同种物质的是_______________。
(3)已知溴水能氧化醛基,若只允许使用一种试剂检验纯物质①中的碳碳双键,该试剂为____。
(4)⑩分子中只有碳氢两种元素,其系统命名为________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】废镍催化剂中主要有Ni,还有Al、Fe、SiO2及其它不溶于酸、碱的杂质。现用废镍催化剂制备NiSO4·7H2O晶体,其流程如下图:

已知:Ksp[Fe(OH)3]=8.0×10-38,Ka sp[Fe(OH)2]=8.0×10-16,K[Al(OH)3]=3.2×10-34,Ksp[Ni(OH)2]=2.0×10-15,1g2=0.3,
回答下列问题
(1)“碱浸”的目的是______。
(2)“酸浸时发生的离子方程式为Fe+2H+=Fe2++H2↑、_______。
(3)“净化除杂需要先加入H2O2溶液,发生反应的离子方程式为______,然后调节PH=_______时,使杂质离子恰好完全沉淀(注:离子浓度小于或等于1×10-5mol/L时沉淀完全)
(4)“操作A为”______。
(5)Ni2+在强碱性溶液中还可被NaClO氧化为NiOOH,该反应离子方程式为______。
(6) NiOOH也可作为原电池的电极材料,若在碱性条件下形成燃料电池,负极通入N2H4气体,则负极的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:1.饱和NaClO溶液pH为1l;2.25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HCO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称_______,装置A中发生反应的离子方程式_____。
②C瓶溶液中的溶质是NaCl、______(填化学式)。
③若将C瓶溶液换成 NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7。结合平衡移动原理解释紫色石蕊试液立即褪色的原因_______。
(2)测定C瓶溶液中NaClO含量(单位:g)的实验步骤如下:
Ⅰ.取C瓶溶液20ml于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00ml。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为______。
②通常选用______作指示剂,滴定至终点的现象______。
③C瓶溶液中NaClO含量为_______g/L(保留2位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用氯酸钾与10 mol·L-1盐酸反应制氯气并进行氯气性质的探究,实验装置如图所示:

请回答:
(1)装置F的名称是____________。
(2)E中实验现象是___________。
(3)根据相关实验现象就可以证明起漂白作用的不是氯气而是次氯酸,相关现象是_________。
(4)现要配制240mL 10 mol·Lˉ1所需盐酸,请回答下列问题:
①所用的仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是_________。
②配制好的盐酸放入试剂瓶中后,需要贴上标签,请你在图标签上填好所配溶液的信息_________。

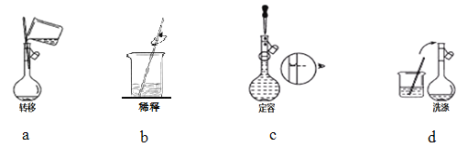
③配制过程中有下列实验操作步骤,其正确的顺序为___________________。
④下列操作会使配制结果偏高的是__________________。
A.容量瓶洗净后未干燥直接用来配制溶液
B.反复摇匀后发现液面低于刻度线,继续加水至刻度线
C.定容时俯视读数
D.用量筒量取浓盐酸配制所需盐酸时,量筒仰视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B均为钾盐的水溶液,A呈中性,B有氧化性,E的溶质中有一种含+5价元素的含氧酸盐M。现有下图所示转化:
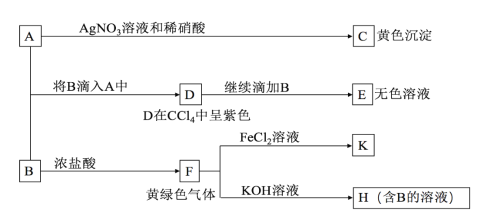
请回答:
(1)C的化学式为_________,检验气体F常用的试纸是______________
(2)写出物质M在生活中的常见用途______________
(3)写出F→H的化学方程式:______________
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,0.1 mol/L H2A溶液中存在H2A、HA和A2-三种形态的粒子,其物质的量分数δ(x)随溶液PH变化的关系如图所示[已知δ(x)=c(X)/(C(H2A)+ C(HA-)+C(A2-)),下列说法不正确的是(图中a=1.35、b=4.17)

A. PH=7的溶液中C(Na+)=2[(C(A2-)+C(HA-)+C(H2A)]
B. 0.lmol/LNaHA溶液中C(OH-)+C(A2-)=C(H+)+C(H2A)
C. 已知Pka=-1gKa,则Pka2=4.17
D. PH=3的溶液中C(HA-)>C(A2-)+C(H2A)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com