
科目: 来源: 题型:
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由此分析,该反应的化学方程_____________________________________;从反应开始至2 min,Z的反应速率为_____ mol·L-1·min-1。

(2)若上述反应的△H<0,下列有关该反应速率的叙述,正确的是_________。
A.升高温度和增大压强均可以增大活化分子百分数,加快反应速率
B.使用催化剂可以使反应的活化能降低,加快反应速率
C.活化分子间所发生的碰撞为有效碰撞
D.降低温度,v正、v逆均减小且v正减小的倍数小于v逆减小的倍数
(3)在一密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
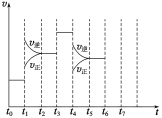
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氦气
t1时刻________;t3时刻________;t4时刻________(填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下 0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是

A. HA-![]() H+ + A2- K=10-4.2
H+ + A2- K=10-4.2
B. 在 0.1mol/L NaHA 溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F﹣═ HF+HA﹣
D. 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,极易溶于水,不与水反应。若温度过高,二氧化氯的水溶液可能会发生爆炸。某研究性学习小组拟用如下图所示装置制取并收集ClO2(加热和夹持装置均省略)。

(1)在圆底烧瓶中先放入一定量的KClO3和草酸H2C2O4),然后再加入足量的稀硫酸,在60~80℃之间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为________。
(2)装置A中使用温度计的目的是____。反应开始后,可以观察到圆底烧瓶内的现象是_____。
(3)装置B的作用是________。
(4)实验过程中装置D中的溶液里除生成Na2CO3外,还生成物质的量之比为1︰1的另外两种盐,一种为NaClO3,另一种为_______。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液20mL,稀释成100mL试样,量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用 cmol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V2mL。
已知:2ClO2+8H++10I-==5I2+2C1-+4H2O 2Na2S2O3+I2=Na2S4O6+2NaI
请回答:
①配制100mL步骤3中所需的Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要_______。(填仪器名称)
②步骤3中滴定终点的现象为_______。
③原ClO2溶液的浓度为_______g·L-1(用含字母的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的_____。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用。。。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)_____。其中②中的操作中。。。处填“改用________。”
(4)使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会影响所配溶液的浓度(填“偏高”、“偏低”或“无影响”)
①用天平(不使用游码)称量时,被称量物与砝码的位置放颠倒了____
②用量筒量取液体溶质,读数时俯视量筒,所配溶液的浓度____
③用胶头滴管定容时,仰视刻度线,所配溶液的浓度____
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组在一个恒压密闭容器中加入CH3OH和CO气体,发生反应CH3OH(g) + CO(g) ![]() CH3COOH(l)。已知在某温度下,达到平衡时,CH3OH(g)、CO(g)、CH3COOH(l)的物质的量分别为0.08mol、0.10mol、0.12mol,且容器的体积刚好为2L。往上述已达到平衡的恒压容器中,再在瞬间通入0.12mol CH3OH和0.06molCO混合气体,平衡的移动方向为
CH3COOH(l)。已知在某温度下,达到平衡时,CH3OH(g)、CO(g)、CH3COOH(l)的物质的量分别为0.08mol、0.10mol、0.12mol,且容器的体积刚好为2L。往上述已达到平衡的恒压容器中,再在瞬间通入0.12mol CH3OH和0.06molCO混合气体,平衡的移动方向为
A. 正向 B. 逆向 C. 不移动 D. 无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)元素的种类由_________决定。
(2)19 g 某二价金属的氯化物 ACl2 中含有 0.4mol Cl-,则 A 的摩尔质量为______。
(3) ____molSO2中含有的O原子数与标准状况下4.48L的NH3的氢原子数相同。
(4) NaHSO4在熔化状态下的电离方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向1L0.1mol·L-1NH4Cl溶液中不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,![]() 不断增大
不断增大
D. 当n(NaOH)=0.05mo1时,溶液中有:c(Cl-)> c(NH4+)>c(Na+)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】加热N2O5,依次发生分解反应:①N2O5(g)![]() N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g)![]() N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5,加热到T ℃时反应达到平衡状态,此时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T ℃时反应①的平衡常数为
N2O(g)+O2(g)。在体积为2 L的恒容密闭容器中充入8 mol N2O5,加热到T ℃时反应达到平衡状态,此时O2和N2O3的物质的量分别为9 mol、3.4 mol,则T ℃时反应①的平衡常数为
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
科目: 来源: 题型:
【题目】2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。其总反应方程式为: xLi + Li1-xMn2O4 ![]() LiMn2O4下列叙述错误的是
LiMn2O4下列叙述错误的是

A. a为电池的正极
B. 放电时,溶液中Li+从b向a迁移
C. 充电时,外接电源的负极与b相连
D. 可用Na2SO4溶液代替Li2SO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】最近我国科学家在液流电池研究方面取得新进展。一种硫/碘体系(KI/K2S2)的液流电池工作原理如图所示。下列说法正确的是( )

A. 放电时电池右侧为负极,发生氧化反应
B. 放电时电池左侧的电极反应为S22-+2e-==2S2-
C. 充电时电解质溶液中K经交换膜向右侧移动
D. 充电时电池的总反应为3I-+S22-=I3-+2S2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com