
科目: 来源: 题型:
【题目】如图为二氧化锰的有关转化关系图,下列有关说法中不正确的是( )
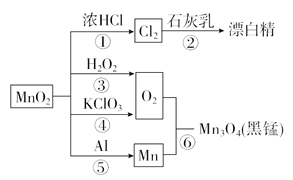
A. 反应①~⑥均属于氧化还原反应
B. 反应⑤中氧化剂与还原剂的物质的量之比为3∶4
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D. 反应①生成的Cl2经干燥后,可用钢瓶贮运
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol;用平衡移动原理解释阴极区pH增大的原因:___________________________________________________________
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:

(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式________。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
(3)滤液中金属阳离子的检验方法__________。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由____。(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:

已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整
![]() _____
_____
②过程II反应的离子方程式__________。
③研究发现,用氧化亚铁硫杆菌(T.f)脱硫,温度过高脱硫效率降低(如图),可能的原因是____。

(6)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液b mL。反应原理:6Fe2++Cr2O72-+14H+ =6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为_____。(FeSO4·7H2O摩尔质量为278 g/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①写出CO2的电子式__________。
②用饱和Na2CO3溶液做吸收剂可“捕集”CO2。若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式___________。
③聚合离子液体是目前广泛研究的CO2 吸附剂。结合下图分析聚合离子液体吸附CO2的有利条件是__________。

(2)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H =-159.5 kJ/mol
H2NCOONH4(s) △H =-159.5 kJ/mol
第二步:H2NCOONH4(s)![]() CO(NH2)2(s)+ H2O(g) △H =+116.5 kJ/mol
CO(NH2)2(s)+ H2O(g) △H =+116.5 kJ/mol
①写出上述合成尿素的热化学方程式_________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第______步反应决定,总反应进行到________min时到达平衡。
(3)合成乙酸:
①中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:

原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___。
②根据图示,写出总反应的化学方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物P是合成抗肿瘤药物的中间体,其合成路线如下:

已知: ![]()
(1)A可与NaHCO3溶液反应,写出A的官能团名称_____。
(2)A→B的反应类型_____。
(3)C→D的化学方程式_____。
(4)检验F中官能团的试剂及现象_____。
(5)G→H所需的试剂a是______。
(6)D→E的化学方程式______。
(7)已知:
K经过多步反应最终得到产物P:

①L的结构简式___________。
②Q→M的化学方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2 mol·L-1盐酸 | 产生黄绿色气体 |
② | 0.2 mol·L-1 KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2 mol·L-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2mol·L-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A. 实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B. 实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C. 实验③中该条件下氧化性强弱:ClO->Fe3+
D. 实验④中ClO-与Al3+相互促进水解
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题
(1)常温下,H2SO3的电离常数Ka1=1.0×10-2、Ka2=1.0×10-7。NaHSO3的水解平衡常数Kh=________,其溶液pH________(填“>”“<”或“=”)7;若向NaHSO3溶液中加入少量的I2(I2能氧化+4价的硫),则溶液中c(H2SO3)/c(HSO3-)将________(填“增大”“减小”或“不变”)。
(2)已知25 ℃时,Ksp[Mg(OH)2]=1.8×10-11。25 ℃时,向0.01 mol·L-1的MgCl2溶液中逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的c(H+)为________;当Mg2+完全沉淀时,溶液的pH为________。(忽略溶液体积变化,已知![]()
![]() ,lg 7.7=0.9)
,lg 7.7=0.9)
(3)量取10.00 mL密度为1.13 g·mL-1的H2O2溶液至烧杯中稀释,冷却后转移至250 mL容量瓶中,加水定容,摇匀。移取配制好的过氧化氢溶液25.00 mL至锥形瓶中,加入稀H2SO4酸化,用蒸馏水稀释,作被测试样。用KMnO4标准溶液滴定被测试样,重复滴定三次,平均耗用1 mol·L-1KMnO4标准溶液11.30 mL,则
①滴定到达终点的现象___________________________________________
②原H2O2溶液中H2O2的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】LiAlH4是金属储氢材料,遇水剧烈反应释放出H2,LiAlH4在125℃时分解为LiH、H2和Al。下列说法正确的是( )
A.LiAlH4中Al的化合价为-5价
B.LiAlH4与水反应时,LiAlH4作还原剂
C.LiAlH4在125℃时完全分解,每生成2mol H2,转移电子数2NA个
D.LiH是反应的还原产物
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH=+19 kJ·mol-1 ③
请写出CO还原FeO的热化学方程式:_______________________。
(2)某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
①T ℃时,该反应的平衡常数K=________。
②30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A
c.适当缩小容器的体积 d.升高反应体系温度
③若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。

查看答案和解析>>
科目: 来源: 题型:
【题目】HI在一定条件下可发生反应 2HI(g) ![]() H2 (g)+I2(g) △H,在2L恒容密闭容器中,充入一定量的 HI(g),反应物的物质的量 n(mol)随时间t(min)变化的数据如下:
H2 (g)+I2(g) △H,在2L恒容密闭容器中,充入一定量的 HI(g),反应物的物质的量 n(mol)随时间t(min)变化的数据如下:

根据表中数据,下列说法正确的是
A. 实验 1中,反应在 0至 10min内,v(HI)=0.02mol·L-1 ·min-1
B. 800℃时,该反应的平衡常数K=0.25
C. 根据实验 1和实验2可说明:反应物浓度越大,反应速率越快
D. △H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com