
科目: 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | 新制氯水滴入Na2S 溶液中 | 乙醇滴入K2Cr2O7酸性溶液中 | 饱和FeCl3溶液滴入沸水中 | 草酸滴入KMnO4 酸性溶液中 |
现象 | 产生黄色浑浊 | 溶液由橙色变为绿色 | 液体变为红褐色且澄清透明 | 产生无色气体,溶液紫红色褪去 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】锰的化合物在工业、医疗等领域有重要应用。某兴趣小组模拟制备KMnO4及探究锰(II)盐能否被氧化为高锰(VII)酸盐。
I.KMnO4的制备:
![]()
反应原理
步骤一:3MnO2+6KOH+KClO3![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
步骤二:3K2MnO4+2CO2 =2KMnO4+MnO2+2K2CO3
实验操作
步骤一:将一定比例的MnO2、KOH和KClO3 固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性K2MnO4溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取KMnO4晶体。
装置图如下:

(1)检查装置A气密性:关闭分液漏斗活塞,在B中加入蒸馏水至液面超过长导管口,用热毛巾捂住圆底烧瓶,若__________,则说明装置气密性良好。
(2)B中试剂选择的理由________。
(3)反应结束后,未能及时分离KMnO4晶体,发现C中紫红色溶液变浅。该小组同学认为是碱性K2MnO4溶液中的Cl-将生成的MnO4- 还原,导致颜色变浅,指出含有Cl-的判断依据_____________。
II.该小组继续探究Mn2+能否氧化为MnO4-,进行了下列实验:
装置图 | 试剂X | 实验现象 |
| ① 0.5mL 0.1mol/LNaOH溶液 | 生成浅棕色沉淀,一段时间后变为棕黑色 |
②0.5mL 0.1mol/LNaOH 和15%H2O2 混合液 | 立即生成棕黑色沉淀 | |
③ 0.5mL 0.1mol/LHNO3溶液 | 无明显现象 | |
④ 0.5mL 0.1 mol/LHNO3溶液和少量PbO2 | 滴加HNO3无明显现象,加入PbO2立即变为紫红色,稍后紫红色消失,生成棕黑色沉淀 |
已知:i.MnO2为棕黑色固体,难溶于水;
iiKMnO4在酸性环境下缓慢分解产生MnO2。
(4)实验①中生成棕黑色沉淀可能的原因_____。
(5)实验②中迅速生成棕黑色沉淀的离子方程式_____。
(6)对比实验③和④,实验③的作用_____。
(7)甲同学猜测实验④中紫红色消失的原因:酸性条件下KMnO4不稳定,分解产生了MnO2,乙认为不成立,理由是________;乙认为是溶液中的Mn2+将MnO4- 还原,并设计了实验方案证明此推测成立,其方案为_________。
探究结果:酸性条件下下,某些强氧化剂可以将Mn2+氧化为MnO4-。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包白色固体粉末,其中可能含有NaCl、Ba(NO3)2、CuSO4、Na2CO3、KNO3中的一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤后溶液呈无色;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量硝酸酸化的AgNO3溶液产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是________,一定不含的物质是________,可能含有的物质是________。(以上各种物质均写化学式)
(2)写出下列步骤中发生反应的离子方程式:
①_______________________________________________________;
②_______________________________________________________;
④_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)的能量变化如图所示,有关叙述中不正确的是( )
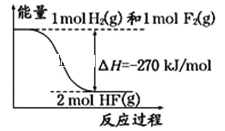
A. 氟化氢气体分解生成氢气和氟气的反应是吸热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H﹣H键和1 mol F﹣F 键吸收的能量小于形成2 mol H﹣F键放出的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】N2(g)与H2(g)在铁催化剂表面经历如图所示过程生成NH3,下列说法正确的是
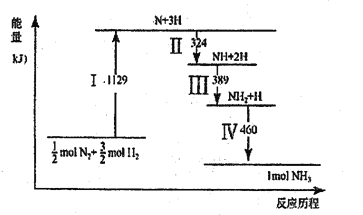
A. Ⅰ中破坏的均为极性键
B. Ⅱ、Ⅲ、Ⅳ均为放热过程
C. Ⅳ中NH2与H2生成NH3
D. N2(g)+3H2(g) ![]() 2NH3(g)ΔH>0
2NH3(g)ΔH>0
查看答案和解析>>
科目: 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得25℃、101 kPa时,1 mol甲醇完全燃烧释放726.51kJ的热量,下列热化学方程式书写正确的是( )
A. 2CH3OH+3O2=2CO2+4H2O ΔH=-1453.02 kJ·mol-1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=+1453.02 kJ·mol-1
C. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.51 kJ·mol-1
D. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-726.51 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)用系统命名法命名下列物质或者根据名称写出对应的结构简式
 _________________________
_________________________
CH3CH(CH3)CH2CH(CH3)CH(CH3)CH3 ___________________________
3,4,4-三甲基-1-戊炔_____________
(2)指出下列物质中的官能团

甲_______________ 乙____________ 丙_______________
(3)① C5H10Cl2的同分异构体有__________种
② 苯环上含 -C3H6Cl -CH3 -C4H9三个取代基的同分异构体有_____种
(4)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究.

步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水.
步骤二:通过仪器分析得知X的相对分子质量为106.
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3 (如图Ⅰ)

步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ. 试填空:
①X的分子式为___________;X的习惯命名为___________;
②步骤二中的仪器分析方法称为___________
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为 _________ mol/L;
(2)某学生欲用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.400mol/L的稀盐酸,
①该学生需要量取__________ mL上述浓盐酸进行配制;
②所需玻璃仪器有:玻璃棒、烧杯、量筒、__________ 、__________ ;
③在配制过程中,下列实验操作会导致所配制的稀盐酸的物质的量浓度偏高的有__________ 。
A.定容时,俯视容量瓶刻度线进行定容;
B.在烧杯中将浓盐酸进行稀释后立即转入容量瓶;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水;
E.定容摇匀后,发现液面低于刻度线,再加蒸馏水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com