
科目: 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目: 来源: 题型:
【题目】18世纪70年代,瑞典化学家舍勒将软锰矿与浓盐酸混合加热,发现了氯气的方法至今还是实验室制备氯气的主要方法,下列关于实验室制氯气的说法中正确的是( )
A.浓盐酸在反应中起到酸性和氧化剂作用
B.将87g MnO2和足量浓盐酸反应,与将含有146gHCl的浓盐酸与足量MnO2反应制得的氯气一样多
C.为防止氯气污染环境,必须进行尾气处理,可选用饱和石灰水
D.收集氯气时,可采用湿润的淀粉KI试纸进行验满
查看答案和解析>>
科目: 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
元素 | A | B | C | D |
性质结构信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的电子排布式__________
(2)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为__________,简要描述该配合物中化学键的成键情况:__________
(3)“。”表示氢原子,小黑点“·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是__________(填序号);在②的分子中有__________个σ键和__________个π键
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
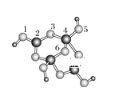
在Xm-中,硼原子轨道的杂化类型有__________;配位键存在于__________原子之间(填原子的数字标号);m=__________(填数字)
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀;在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的化学式为__________,第二种配合物的化学式为_________ .
查看答案和解析>>
科目: 来源: 题型:
【题目】在研究原子核外电子排布与元素周期表的关系时, 人们发现价电子排布相似的元素集中在一起。据此,人们将元素周期表分为五个区,并以最后填入电子的轨道能级符号作为该区的符号,如下图所示。

(1)在![]() 区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为__________。
区中,族序数最大、原子序数最小的元素,原子的价电子的电子云形状为__________。
(2)在![]() 区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为__________,其中较稳定的是__________。
区中,族序数最大、原子序数最小的元素,常见离子的电子排布式为__________,其中较稳定的是__________。
(3)在第4周期的![]() 区中,族序数最大、原子序数最大的元素,原子的价电子排布式为__________。
区中,族序数最大、原子序数最大的元素,原子的价电子排布式为__________。
(4)在![]() 区中,第2周期VA族元素原子价电子排布图为__________。
区中,第2周期VA族元素原子价电子排布图为__________。
(5)当今常用于核能开发的元素是铀和钚,它们在__________区中。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型可逆电池的工作原理如下图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。
4Al2Cl7-+3Cn(Cn表示石墨)。

下列说法正确的是
A. 放电时负极反应为:2Al-6e-+7Cl-= Al2Cl7-
B. 放电时AlCl4-移向正极
C. 充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4)
D. 电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析化学、医药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol·L-1的NH4Al(SO4)2溶液中c((NH4+)________(填“等于”、“大于”或“小于”)0.1mol·L-1 NH4HSO4中c((NH4+).
(3)均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示.

①其中符合0.1mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是__,导致pH随温度变化的原因是___________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______.
(4)室温时,向100mL0.1mol·L-1的NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH与所加NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是________.
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答下列问题。

(1)A是铅蓄电池的___________极,铅蓄电池正极反应式为___________,放电过程中电解液的密度___________ (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是___________,该电极的电极产物共____________g。
(3)Cu电极的电极反应式是____________,CuSO4溶液的浓度____________(填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示___________。

a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25 ℃,醋酸溶液中各微粒存在下述关系:K= ![]() =1.75×10-5,下列有关说法可能成立的是
=1.75×10-5,下列有关说法可能成立的是
A. 25 ℃条件下,向该溶液中加入一定量的盐酸时,K=8×10-5
B. 25 ℃条件下,向该溶液中加入一定量的盐酸时,K=2×10-4
C. 标准状况下,醋酸溶液中K=1.75×10-5
D. 升高到一定温度,K=7.2×10-5
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应H2(g)+I2(g) ![]() 2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度____________;
(2)加入催化剂__________;
(3)充入更多的H2_________________;
(4)扩大容器的体积___________________;
(5)容器容积不变,通入氖气_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com