
科目: 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A(g)和B,发生反应:xA(g)+2B(s) ![]() yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。

请回答下列问题
(1)根据图示可确定x:y=________。
(2)0-10min容器内压强______ (填“变大”、“ 不变”或“变小”)
(3)推测第10min引起曲线变化的反应条件可能是______(填编号,下同);第16min引起曲线变化的反应条件可能是________。
①减压 ② 增大A的浓度 ③增大C的量 ④升温 ⑤ 降温⑥ 加催化剂
(4)若平衡1的平衡常数为K1,平衡II的平衡常数为K2,则K1______(填“>”“=”或“<”)K2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,氯元素全部被氧化的是( )
A.2P+3Cl2![]() 2PCl3B.2NaCl(熔融)
2PCl3B.2NaCl(熔融) ![]() 2Na+Cl2↑
2Na+Cl2↑
C.NaOH+HCl=NaCl+H2OD.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
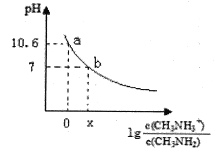
A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C. b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D. V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应H2(g)+ I2(g)![]() 2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
化 学 键 | H—H | I—I |
断开1 mol化学键时吸收的能量(kJ) | b | c |
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H-H 键和1 mol I-I 键所需能量大于断开2 mol H-I 键所需能量
C.断开2 mol H-I键所需能量为(a+b+c)kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A.H2+Cl2![]() 2HClB.Cl2 + H2O= HCl + HClO
2HClB.Cl2 + H2O= HCl + HClO
C.NH4HCO3![]() NH3↑+CO2↑+H2OD.Zn+H2SO4=H2↑+ZnSO4
NH3↑+CO2↑+H2OD.Zn+H2SO4=H2↑+ZnSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,A的简单离子焰色反应为黄色。B的最高价氧化物对应水化物B(OH)2 5.8 g恰好能与100 mL 2 mol·L-1盐酸完全反应;且B原子核中质子数和中子数相等。E2在黄绿色气体C2中燃烧产生苍白色火焰。D原子的最外层电子数是次外层电子数的3倍,F和D同主族。 根据上述条件回答:
(1)写出元素B的名称 ,元素C在元素周期表中的位置 。
(2)A、D形成淡黄色化合物,该物质中含有的化学键类型为 。
(3)C2与ADE溶液反应的离子方程式为 。
(4)用电子式表示BC2的形成过程 。
(5)由元素D和E构成的9e-微粒名称是 。
(6)比较元素C和F的气态氢化物的稳定性 > (用化学式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法错误的是( )

A. 装置左侧电极为负极,电子由该极出发,依次通过正极、电解质溶液,回到负极
B. 正极的反应式为:H2O2+2H++2e-=2H2O
C. 电池工作时,H+通过质子交换膜向正极移动,
D. 消耗3.lg氨硼烷,理论上转移0.6mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化钠是日常生活的必需品,也是重要的化工原料。粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是粗盐提纯的操作流程。

限选试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
(1)欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按滴加顺序依次为:过量的NaOH溶液、______、____。
(2)在滤液中加盐酸发生反应的化学方程式是_____;
(3)对溶液II处理得到晶体时,所必须使用到的玻璃仪器有_____种。
(4)得到的NaCl纯品经测定发现其含有的NaCl与粗盐中NaCl的质量一致,某同学认为此次实验非常成功没有误差,你是否同意他的观点?____(填“是”或“否”),并给出你的理由____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关粒子浓度关系正确的是( )
A. 0.2mol/L的NaHCO3溶液:c(HCO3-)>c(CO32-)>0.1mol/L>c(H2CO3)
B. pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C. 0.2mol/L CH3COOH溶液和0.2mol/L CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
D. 浓度均为0.1mol/L的①NH4Cl ②NH4Al(SO4)2 ③NH4HCO3三种溶液,其中c(NH4+):③>①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①KCl晶体 ②液态HCl ③CO2 ④汞 ⑤CaCO3固体 ⑥稀硫酸 ⑦酒精C2H5OH ⑧熔融的NaCl ⑨浓氨水
其中属于混合物的是(填序号,下同)___;属于电解质的是___;属于非电解质的是___;能导电的有____。
(2)某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
①将1mol·L-1的FeCl3 溶液逐滴滴入沸水中,液体变为__色,得到的是Fe(OH)3胶体;反应的化学方程式为____。
②怎样证明制得的物质是胶体?请简述操作过程:____。
③取少量制得的胶体加入试管中,再加入少量NaCl溶液,观察到的现象是__,这种现象称为胶体的____。
④Fe(OH)3胶体能稳定存在的主要原因是___(填序号)。
A.胶粒直径小于1nm B.胶粒带正电荷
C.胶体离子作无规则运动(即布朗运动) D.胶粒能透过滤纸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com