
科目: 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A. 4s时c(B)为0.78 mol/L
B. 该反应AH>0
C. 830℃达平衡时,A的转化率为20%
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为2.5
A(g)+B(g)的平衡常数为2.5
查看答案和解析>>
科目: 来源: 题型:
【题目】“结晶玫瑰”是具有强烈玫瑰香气的结晶型固体香料,在香料和日用化工产品中具有广阔的应用价值。其化学名称为“乙酸三氯甲基苯甲酯”,目前国内工业上主要使用以下路径来合成结晶玫瑰:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶政瑰”。

已知:
三氯甲基苯基甲醇 | 相对分子质量:225.5。无色液体。不溶于水,密度比水大,溶于乙醇 |
乙酸酐 | 无色液体。与水反应生成乙酸,溶于乙醇 |
“结晶玫瑰” | 相对分子质量:267.5。白色晶体。熔点:88℃。不溶于水,溶于乙醇 |
具体实验步骤如下:
I.由苯甲醛和氯仿合成三氯甲基苯基甲醇。
步骤一:装置如图所示。依次将苯甲醛、氯仿加入三颈烧瓶中,仪器A中加入KOH和助溶剂。滴加A中试剂并搅拌,开始反应并控制在一定温度下进行。

步骤二:反应结束后,将混合物依次用5%的盐酸、蒸馏水洗涤。
步骤三:将洗涤后的混合物蒸馏,除去其他有机杂质,加无水琉酸镁,过滤。滤液即为粗制三氯甲基萃基甲醇。
Ⅱ.三氯甲基苯基甲醇与乙酸酐发生乙酰化反应制得“结晶玫瑰”。
步骤四:向另一三颈瓶中加入制备的三氯甲基苯基甲醇、乙酸酐,并加入少量浓硫酸催化反应,加热控制反应温度在90℃~110℃之间。
步骤五:反应完毕后,将反应液倒入冰水中,冷却结晶获得“结晶玫瑰”。
请回答下列问题:
(1)仪器A的名称是_________。实验装置B中,冷凝水应从_____口进(填“a”或“b”)。
(2)步骤二中,用5%的盐酸洗涤的主要目的是___________。在洗涤、分液操作中,应充分振荡,然后静置,待分层后有机层应___________ (填序号)。
A.直接从上口倒出
B.先将水层从上口倒出,再将有机层从下口放出
C.直接从下口放出
D.先将水层从下口放出,再将有机层从下口放出
(3)步骤三中,加入无水硫酸镁的目的是___________。若未加入无水硫酸镁,直接将蒸馏所得物质进行后续反应,会使“结晶玫瑰”的产率偏______(填“高”或“低”),其原因是___________ (利用平衡移动原理解释)。(已知Ⅱ的具体反应如图所示)

(4)步骤四中,加料时,应先加入三氯甲基苯基甲醇和乙酸酐,然后慢慢加入浓硫酸并搅拌,主要是为了__________。加热反应时,为较好的控制温度,最适宜的加热方式为_____(填“水浴加热”或“油浴加热”)。
(5)22.55g三氟甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰21.40g,则产率是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:AG=lg[ ]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是
]。室温下,实验室里用0.10 mol/L 的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是

A. 该滴定过程可选择酚酞作为指示剂
B. C点加入盐酸的体积为10mL
C. 若B点加入的盐酸溶液体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH)
D. 滴定过程中从A点到D点溶液中水的电离程度逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】—定条件下,恒压容器中发生反应:2X(g)+Y(g)![]() 2Z(g), △H=-akJ·mol-1(a>0)。下列说法不正确的是
2Z(g), △H=-akJ·mol-1(a>0)。下列说法不正确的是
A. 单位时间内生成2n mol X,同时生成nmol Y
B. 混合体系的密度不再变化,说明该反应达到化学平衡状态
C. 反应过程中,X和Z的物质的量之和保持不变
D. 向容器中加入0.2 mol X与0.1 molY充分反应,放出热量为0.lakJ
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向碳酸钠溶液中加入足量的盐酸:CO32-+2H+=CO2↑+H2O
B.氢氧化钡溶液中加入足量稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++H2O![]() Fe(OH)3↓+H+
Fe(OH)3↓+H+
D.澄清石灰水中加盐酸:Ca(OH)2 +2H+ = Ca2+ + 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A.图甲表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态
B.图乙表示向0.1 mol·L–1的氨水溶液中逐渐加水时溶液的导电性变化
C.图丙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
D.图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,下列说法正确的是( )
CH3COOH+OH-,下列说法正确的是( )
A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小
C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
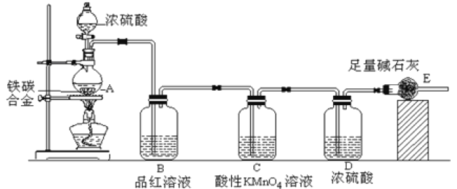
(1)仪器A的名称是___________。
(2)C装置的作用______________。
(3)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是___________。
A.A中反应不完全
B.反应生成的SO2部分被E中碱石灰吸收
C.E中碱石灰会吸收空气中的CO2和H2O
D.反应完全后,还有CO2气体滞留在装置体系中
(二)将19.20 g CuO和Fe2O3的混合物在高温下与足量的CO充分反应,反应后全部气体用200 mL 1.20 molL-1 Ba(OH)2溶液吸收,生成35.46 g白色沉淀(不考虑沉淀的溶解,忽略溶液体积的变化)。
(4)则吸收气体后溶液中溶质的化学式为________,其浓度为_________。
(5)混合物中CuO和Fe2O3的物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,表示稀硫酸与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题目信息完成下列方程式。
(1)钛(Ti)因为具有神奇的性能越来越引起人们的关注。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产的方法是:
第一步:金红石、炭粉混合,在高温条件下,通入Cl2制得TiCl4和一种可燃气体,该反应的化学方程式为:____________________________________________;
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。写出此反应的化学方程式:____________________________________________。
(2)用100mL 0.1mol/L的NaOH溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL 0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com