
科目: 来源: 题型:
【题目】回答下列问题:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) ____________c(CH3COO-)(填“ >”或“=”或“<” )。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3) 99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw=________,水电离出的c(H+)=________,而此时溶液中的c(Na+)__________ c(SO42-)(填“>”“=”或“<”)。
(4)相同温度下等物质的量浓度的下列溶液中
A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是__________(用对应的字母填写)。
②NH4+离子浓度由大到小的顺序是__________(用对应的字母填写)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2mol CO和4mol H2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2mol CO和4mol H2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
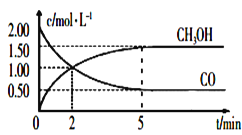
①从反应开始到5min,用CO表示的平均反应速率v(CO)=________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ·mol1
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= 43kJ·mol1
Ⅲ:CaO(s)+CO2(g)=CaCO3(s) △H= 178.3kJ·mol1
①计算反应ⅣC(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=_______kJ·mol1;若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=_____(用K1、K2、K3表示)。
CaCO3(s)+2H2(g)的△H=_______kJ·mol1;若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=_____(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目: 来源: 题型:
【题目】关于有机物(![]() )的结构、性质有关的叙述正确的是
)的结构、性质有关的叙述正确的是
A. 该物质所有原子可能在同一平面
B. 与该物质具有相同官能团的芳香烃同分异构体有2种
C. 该物质在一定条件下能发生加成反应、氧化反应、取代反应、加聚反应
D. 1mol该物质最多可与1moBr2反应
查看答案和解析>>
科目: 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的含酸量(g/100 mL)。
Ⅰ、实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如下图所示,则此时的读数为________mL。
![]()
(4)滴定。当______________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ、实验记录

Ⅲ、数据处理与讨论:
(1)按正确数据处理,可得市售白醋含酸量=________g/100 mL(结果保留四位有效数字)。
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的______(填写序号)。
a.pH b.沸点 c.电离常数 d.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】(Ⅰ)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
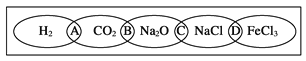
(1)请将分类依据代号填入相应的括号内:
_______两种物质都不是电解质
_______两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为_____。
②涉及到的化学方程式是____。
③证明有红褐色胶体生成的实验操作是_____。
(Ⅱ)反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,还原剂与氧化剂的物质的量之比:___,当有0.6mol电子转移时。生成的NO在标准状况的体积为____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molAlCl3在熔融状态吋含有的离子总数为0.4NA
B. 某温度下纯水的pH=6,该温度下10LpH=11的NaOH溶液中含OH-的数目为NA
C. 8.7g二氧化锰与含有0.4molHCl的浓盐酸加热充分反应,转移电子的数目为0.2NA
D. 12g金刚石中C-C键的数目为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】由S、Cl及Fe、Co、Ni等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的电子排布式为_______,P、S、C1的第一电离能由大到小顺序为________。
(2)SCl2分子中的中心原子杂化轨道类型是_______,该分子空间构型为________。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_______。Ni(CO)4中σ键与π键个数比为______,已知:Ni(CO)4熔点-19.3℃,沸点43℃,则Ni(CO)4为_______晶体。
(4)已知NiO的晶体结构如图1所示。
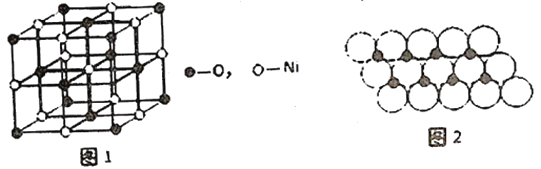
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的____体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO____NiO(填“>”、“<”或“=”),理由是_______________。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2),己知O2-的半径为am,每平方米面积上分散的NiO的质量为______g。(用a、NA表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标准状况下:①0.3mol氨气 ②6.02×1022个CO2分子 ③7.3gHCl ④0.2molCH4。体积最大的是___;密度最大的是___;质量最大的是___。(填序号)
(2)相同质量的SO2与SO3,其物质的量之比为___,氧元素的质量之比为___,原子总数之比为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O

请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
C装置质量 | F装置气体的体积(已折算为标准状况) | ||
玻管质量 | Cu质量 | 反应后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com