
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5

(1)装置I中产生气体的化学方程式为__________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是____________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,向20mL 0.01mol·L-1 HF溶液中逐滴加入0.01mol·L-1 KOH溶液,其pH变化曲线如图所示。下列叙述正确的是( )
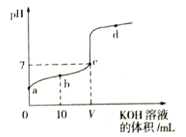
A. 水电离出的H+浓度:a<b<c<d
B. 氢氟酸的电离平衡常数:Ka=![]()
C. V=20
D. b点溶液中:c(F-)>c(HF)
查看答案和解析>>
科目: 来源: 题型:
【题目】氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O![]() HClO + H++Cl-K2=10-3.4
HClO + H++Cl-K2=10-3.4
HClO![]() H++ ClO-Ka=?
H++ ClO-Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )

A. Cl2(g)+ H2O![]() 2H++ ClO-+ Cl-K=10-10.9
2H++ ClO-+ Cl-K=10-10.9
B. 在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时好
D. 氯处理饮用水时,在夏季的杀菌效果比在冬季差
查看答案和解析>>
科目: 来源: 题型:
【题目】发展新能源汽车是国家战略,经过近10年的发展,目前我国新能源汽车产销量均达到80万辆,LiFePO4电池是新能源汽车关键部件之一,其工作原理如图所示。下列说法错误的是( )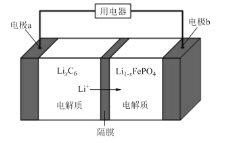
A. 充电时,电极a与电源的负极连接,电极b与电源正极连接
B. 电池驱动汽车前进时,正极的电极反应为:Li1-xFePO4+x Li++x e-= LiFePO4
C. 电池驱动汽车后退时,负极材料减重1.4g ,转移0.4mol电子
D. 电池进水将会大大降低其使用寿命
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目: 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目: 来源: 题型:
【题目】认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A. 将40gNaOH溶解于1L水中
B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L10 mol·L-1的浓盐酸与9L水混合
D. 将10gNaOH溶解于水中配成250mL溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是( )
A. 标准状况下,18g水的体积约为 22.4L
B. 25℃,1.01×105Pa,64gSO2中含有的氧原子数为3NA
C. NA个一氧化碳分子和 0.5mol 甲烷的质量比为 7∶4
D. 同温同压下,相同体积的气体单质含有的原子数目不一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】如图①、②、③、④、⑤五组仪器(可重复使用),选择合适的装置和药品能完成的实验是( )
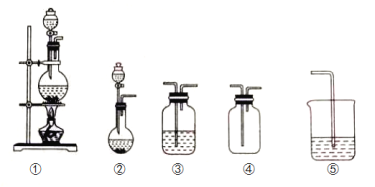
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③③ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA是阿伏加德罗常数的值。下列说法正确的是( )
A. 1mol乙酸乙酯在稀硫酸中水解生成的乙醇分子中含共价键数目为8NA
B. 18.0g葡萄糖和果糖的混合物中含羟基数目为0.5NA
C. 1L0.5mol·L-1 CuSO4溶液清除P4完全反应生成Cu、H2SO4和H3PO4时转移电子数为2.5NA
D. 标准状况下,2.24LD2和H2的混合气体中含中子数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com