
科目: 来源: 题型:
【题目】写出下列盐类水解的离子方程式:
(1)NH4Cl::________________________________
(2)CH3COONa: ________________________________
(3)FeCl3:________________________________
(4)Na2CO3:________________________________、________________________________
(5)NaHCO3:________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷直接脱氢制丙烯发生的主要反应及能量变化如图:

回答下列问题:
(1)丙烷直接脱氢制丙烯为强吸热过程,该反应必须在高温下进行,但温度越高副反应进行程度越大,同时还会降低催化剂的活性和选择性。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)___(填“增大”、“减小”或“不变”)。
②温度升高,副反应更容易发生的主要原因是_______。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强p1、p2分别为1×104 Pa和1×105 Pa)。

①1×104 Pa时,如图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②1×105Pa、500℃时,若只发生上述主反应和副反应,则达平衡时,丙烷转化为丙烯的转化率为____。
(3)为克服丙烷直接脱氢法的缺点,科学家探索出在无机膜反应器中进行丙烷脱氢制丙烯的技术。在膜反应器中,利用特定功能膜将生成的氢气从反应区一侧有选择性地及时移走。与丙烷直接脱氢法相比,该方法的优点是__________。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0kJ/mol、△H =-285.8kJ/mol。
①反应(ⅰ)的化学方程式为_____。
②25℃时,该工艺总反应的热化学方程式为________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组在实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:

已知:①CS2不溶于水,比水重;NH3不溶于CS2;②三颈烧瓶内盛放有CS2、水和催化剂。
实验步骤如下:
(1)制备NH4SCN溶液:CS2+3NH3![]() NH4SCN+ NH4HS(该反应比较缓慢)
NH4SCN+ NH4HS(该反应比较缓慢)
①实验前,经检验装置的气密性良好。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____。
②实验开始时打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,至CS2消失。
则:装置A中反应的化学方程式是_____;装置C的作用是______。
(2)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS= H2S↑ + 3NH3↑),打开K2,再缓缓滴加入适量的KOH溶液,发生反应:NH4SCN + KOH= KSCN + NH3↑ +H2O。
小组讨论后认为:实验中滴加入相同浓度的K2CO3溶液比KOH溶液更好,理由是_____。
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶______,干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品配成1000mL溶液量取20.00mL于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液做指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN- + Ag+= AgSCN↓(白色)。则判断达到终点时的方法是____。
②晶体中KSCN的质量分数为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
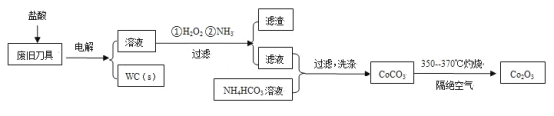
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2R是一种二元弱酸。25℃时,向H2R溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为![]() 或
或![]() ]与pH的变化关系如图所示。下列说法一定正确的是
]与pH的变化关系如图所示。下列说法一定正确的是

A. Ⅱ表示lg![]() 与pH的变化关系
与pH的变化关系
B. pH=1.22的溶液中:2c(R2-)+c(HR-)<c(Na+)
C. NaHR溶液中c(H+)>c(OH-)
D. 当溶液呈中性时:c(Na+)>c(HR-)>c(R2-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,如图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
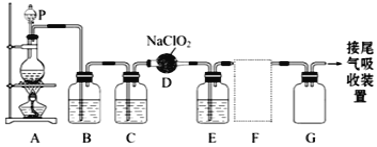
(1)仪器P的名称是___。
(2)实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应,写出D中发生反应的方程式:___。
(3)B装置中所盛的试剂是___。
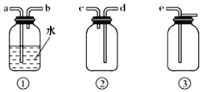
(4)F为ClO2收集装置,应选用的装置是___(填序号),其中与E装置导管相连的导管口是___(填接口字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)有关物质的量浓度的配制下列说法正确的是___
A.称取2.0gNaOH固体:先在托盘各放1张滤纸,然后在右盘加2g砝码,左盘加NaOH固体
B.容量瓶上标有温度和容积使用前要检查是否漏水
C.称取16.0gCuSO4 固体在500mL容量瓶中加水溶解后定容,可配得0.20mol/L的CuSO4溶液
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再慢慢注入浓硫酸
E.配制溶液时,俯视容量瓶刻度线造成浓度偏高
F.溶液转移定容时,溶液未冷却至室温造成浓度偏低
(2)海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(每一步所加试剂均过量):

现有下列仪器,请按要求填写以下空白:
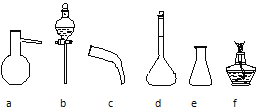
Ⅰ.步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,图中还缺少的玻璃仪器是___。
Ⅱ.如何检验步骤③操作后碘化钠滤液中的碘离子___,步骤⑤所需的操作名称是__。
Ⅲ.写出步骤④的化学反应方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用0.1mol/L HCl溶液滴定未知浓度的氢氧化钠溶液,
(1)写出下列仪器名称
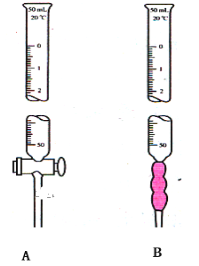
A________________。
B________________。
(2)操作可分解为如下几步:
①检查滴定管是否________________。
②用蒸馏水洗涤滴定管2~3次。
③在加入酸、碱反应液之前,洁净的酸式滴定管和碱式滴定管还要分别用所要盛装的酸、碱溶液________________2~3遍。
④分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上________________处。
⑤装标准溶液和待测溶液并调节液面使滴定管尖嘴充满溶液,准确读取并记录初始_______________。
⑥取一定体积的待测液于锥形瓶中加入指示剂
⑦把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点,记下滴定管液面的刻度.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列水解的离子方程式中书写正确的是
A. S2-+ H2O = HS-+OH- B. CH3COO- + H2O![]() CH3COOH + OH-
CH3COOH + OH-
C. Al3++ H2O =Al(OH)3 D. CO32-+ 2H2O![]() H2CO3+ 2OH-
H2CO3+ 2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统,其工作原理是:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com