
科目: 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)![]() zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
A. x+y<z B. 平衡向逆反应方向移动
C. B的转化率降低 D. C的体积分数下降
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳经济”备受关注,CO2的排集、利用与封存成为科学家研究的重要课题。
(1)将一定量的CO2(g)和CH4(g)通入一恒容密闭容器中发生反应
CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
①已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) △H1=-802kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH2=-283kJ·mol-1
CO(g)+H2O(g)===CO2(g)+H2(g) △H3=-41kJ·mol-1
则反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的△H=___________。
2CO(g)+2H2(g)的△H=___________。
(2)为了探究反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
2CO(g)+2H2(g)的反应速率和平衡。起始时,向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0mol·L-1
①平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线(如图):v正(CO2)和v逆(CO),则与v正(CO2)相对应的是图中曲线___________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为___________(填“D”“E”或“F”),判断的理由______________________。
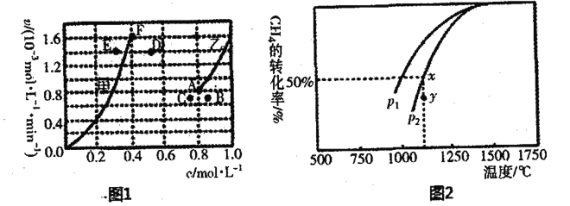
②又测得CH4的平衡转化率与温度及压强的关系如图,当压强为P2时,在y点:v(正)___________v(逆)(选填“大于”、“小于”或“等于”);压强p1___________p2(选填“大于”、 “小于”或“等于”),原因是___________;
若p2=6MPa,则T℃时该反应的平衡常数Kp=___________MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)![]() 3C(g)的下列叙述中,能说明反应已达到平衡的是( )
3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A. C生成的速率与C分解的速率相等
B. 单位时间内消耗amolA,同时生成3amolC
C. 容器内的压强不再变化
D. 混合气体的物质的量不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示人体细胞内化学元素所形成的化合物(①~④表示化合物),下列相关说法错误的是( )

A. ①可以表示蛋白质
B. ②可以表示“生命的燃料”——葡萄糖
C. ③表示的小分子物质可能是核苷酸
D. ④是细胞膜重要的组成成分,可以表示磷脂
查看答案和解析>>
科目: 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,不溶于水)主要适用于不透明的聚氯乙烯硬质管、注射成型制品,也可用于人造革等软质制品。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。

已知:Ksp(PbSO4)=1.82×10-8,Ksp (PbCO3)=1.46×10-13
请回答下列问题:
(1)加入碳酸钠溶液后PbSO4转化为PbCO3。转化的方程式为:PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq),通过计算(保留2位有效数字)说明该反应程度很大的原因:___________。这一步骤中,也可以将碳酸钠溶液改为碳酸氢钠溶液,写出用碳酸氢钠溶液时的离子方程式:___________。
(2)根据图溶解度曲线(g/100g水),由滤液I得到Na2SO4固体的操作为将“滤液1”___________、___________、用乙醇洗涤后于燥。

(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是___________(任意写出一条),生成NO的离子方程式:___________。
(4)“滤液2”中可循环利用的溶质为___________(填化学式)。
步骤④“沉铅”时若将Pb(NO3)2溶液与0.02mol·L-1的H2SO4等体积混合生成PbSO4沉淀时,所需Pb(NO3)2溶液的最小物质的量浓度为___________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】某合作学习小组的同学验证文献上用乙烯气脱除氮氧化物。回答下列问题:
(1)甲组同学设计实验制取纯净的乙烯气体和NO。
①设计的制备C2H4装置如图所示:
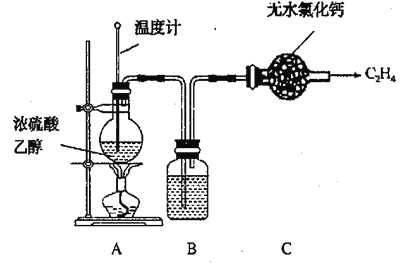
资料:C2H5OH![]() CH2=CH2↑+H2O(主)
CH2=CH2↑+H2O(主)
C2H5OH+2H2SO4(浓)![]() 2C+2SO2↑+5H2O(副)
2C+2SO2↑+5H2O(副)
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O(副)
CO2↑+2SO2↑+2H2O(副)
写出乙烯的电子式___________
装置B中盛放的试剂为___________(填小写字母)。
a KMnO4溶液 b Br2/CCl4溶液 c 浓NaOH溶液 d 浓硫酸
②设计图装置制备NO气体
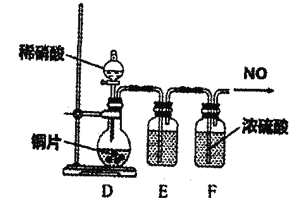
装置D烧瓶中的实验现象为:___________;
装置E盛放的试剂是___________。
(2)乙组利用甲组制得的C2H4和NO并选用下列装置进行催化反应,并检验乙烯的氧化物CO和CO2(部分装置可重复使用,已知C2H4可被热的CuO氧化为碳的氧化物,酸性高锰酸钾可氧化NO和C2H4,不氧化CO)。

①各装置的连接顺序为:
![]() →K→G→___________→H→G→___________→M。(按顺序填一个或多个字母)
→K→G→___________→H→G→___________→M。(按顺序填一个或多个字母)
②K后接的G的作用是___________。
③酸性高锰酸钾溶液的作用是___________。
④证明乙烯的氧化产物中有CO的现象是___________;
若NO还原为N2,乙烯氧化为等物质的量的CO和CO2,则反应的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃下部分弱酸的电离常数如表。下列有关说法不正确的是
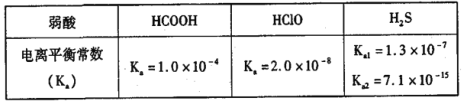
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c( HCOOH)/c(HCOO-)=10
B. 相同pH的 HCOONa和NaClO溶液中离子总浓度前者大
C. 等浓度等体积的Na2S和 HCOOH混合后:c(Na+)=2c(HCOO-)+2c( HCOOH)
D. 向NaClO溶液中通入H2S发生的反应为ClO-+H2S![]() HS-+HClO
HS-+HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:

已知: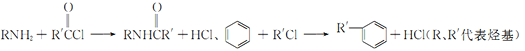
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。

分析产率提高的原因是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图:
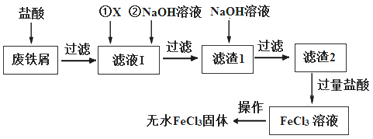
已知:氢氧化物的Ksp下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0×10-36 | 1.6×10-14 | 2.0×10-33 | 1.2×10-11 |
请回答下列问题:
(1)物质X最好选用下列物质中的____(选填序号),加入X的目的是_________。
A.KMnO4 B.FeCl3 C.H2O2 D.HNO3
(2)滤液Ⅰ加入NaOH溶液的目的是调节溶液的pH。已知滤液Ⅰ中c(Fe3+)为1.0mol·L-1,c(Al3+)为0.03mol·L-1,当Fe3+沉淀完全时(c(Fe3+)为1×10-5mol·L-1),Al3+是否已经开始沉淀,请通过计算说明______________。
(3)写出滤渣1加NaOH溶液发应的离子方程式_____________________。
(4)滤渣2中加过量盐酸的目的是_____________________________。
(5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3净水的原理是________。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_________。
②FeCl3在溶液中分三步水解:Fe3++H2O![]() Fe(OH)2++H+ K1,Fe(OH)2++H2O
Fe(OH)2++H+ K1,Fe(OH)2++H2O![]() Fe(OH)2++H+ K2,Fe(OH)2++H2O
Fe(OH)2++H+ K2,Fe(OH)2++H2O![]() Fe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______。
Fe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______。
③通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关钠及其化合物的叙述错误的是( )
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.高压钠灯发出的黄光透雾能力强,可用于道路和广场照明
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和CO2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com