
科目: 来源: 题型:
【题目】化合物环丙叉环丙烷(![]() )具有特殊结构,倍受化学家关注.下列关于该化合物的说法错误的是
)具有特殊结构,倍受化学家关注.下列关于该化合物的说法错误的是
A. 与苯互为同分异构体B. 二氯代物超过两种
C. 所有碳原子均处于同一平面D. 生成1molC6H14至少需要3molH2
查看答案和解析>>
科目: 来源: 题型:
【题目】电影《流浪地球》讲述了太阳即将爆发氦闪”(3He![]() C),人类飞离太阳系的艰辛历程.太阳质量中氢占71%,氦26%,氧、碳、铁等元素占2%左右.下列说法正确的是
C),人类飞离太阳系的艰辛历程.太阳质量中氢占71%,氦26%,氧、碳、铁等元素占2%左右.下列说法正确的是
A. 核素![]() 的中子数比电子数多2
的中子数比电子数多2
B. 上述元素除氮之外仅能形成6种单质和4种氧化物
C. 碳、氢、氧元素组成的糖类物质均可发生水解
D. 上述元素组成的草酸亚铁(FeC2O4)中碳元素的化合价为+3
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是用于治疗帕金森病的药物,名称为匹莫范色林,一种合成路线如图所示:

请回答下列问题:
(1)A的化学名称为_____________。
(2)B的结构简式为____________。
(3)D中官能团的名称是__________。
(4)③、⑤的反应类型分别为________、________。
(5)反应④的化学方程式为______________。
(6)芳香化合物X是E的同分异构体,X中含有两个苯环,能与FeCl3溶液发生显色反应也能发生银镜反应,其核磁共振氢谱显示有6种不同化学环境的氢,符合条件的X有:___种,写出其中一种的结构简式:________。
(7)已知: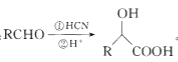 。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备
。参考上述合成路线和信息,设计以化合物A和溴乙烷,乙醇为原料(无机试剂任选).制备 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是最基本的有机化工原料之一。工业上可用二氧化碳和氢气反应来生产甲醇。
(1)已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g) = 2H2O(g) ΔH= -bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
(2)某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2,发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如图中的曲线I,则前4分钟ν(CO2)=__________;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___________;该温度下反应的化学平衡常数为___________。

(3)在另一温度下发生合成甲醇的反应,如图关闭K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。
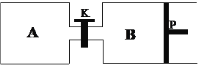
(4)一定条件下甲醇可进一步氧化转化为甲酸。室温下,将amol/L的甲酸与bmol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是两组物质之间在一定的条件下相互转化的过程。下列是绿色植物通过光合作用的图示,则说法不正确的是
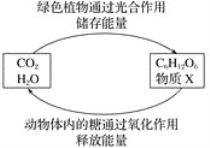
A.物质X是氧气
B.绿色植物的光合作用属于化学变化
C.C6H12O6属于非电解质
D.C6H12O6与X反应生成二氧化碳和水属于置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】依据原电池原理,回答下列问题:
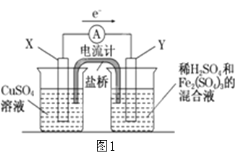
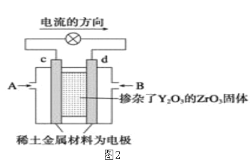
(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】各物质间有着一定的转化关系,下列各组物质间可以按下图所示直接转化的是

A.Na→Na2O→Na2CO3→Na2O2B.CO→CO2→H2CO3→CO
C.NaOH→NaCl→Na2CO3→NaOHD.HCl→CuCl2→BaCl2→HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室测定水体中氯离子含量,实验过程如下:向水样中加入K2CrO4溶液作指示剂,用0.0010 mol·L-1AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管。
(2)滴定达到终点的标志是___________________________________________。
(3)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(4)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ mol·L-1。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(5)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥 B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25ml氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,pH变化曲线如下图所示:

(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH-)=____ mol·L-1。
(3)B点所示溶液中,c(CH3COO-)-c(Na+)=_______________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=_______。
(4)C点所示溶液中,c(CH3COOH)_______c(CH3COO-)。(填“>”、“<”或“=”)
(5)向300 mL上述NaOH溶液中通入448 mL CO2(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是________.
A.c(Na+)+ c(H+)= c(OH-)+ c(HCO3-)+ c(CO32-)
B.2/3c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
D.c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在常温下测得浓度均为0.1molL﹣1的下列四种溶液的pH如下表:
溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
pH | 8.4 | 11.6 | 7.5 | 9.7 |
(1)用离子方程式表示NaClO溶液的pH = 9.7的原因___________________________。
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的由大到小顺序为_________________________________ (填序号)。
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:________________。
(4)常温下,将CO2通入0.1molL﹣1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+ c(HCO3-)=_________________(列计算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com