
科目: 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡,根据要求回答下列问题:
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象 _______________________________________________ 。
(2)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_____________。
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显________(填“酸性”、“碱性”或“中性”);
②作出上述判断的依据是___________________________________________(用文字解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 化学平衡正向发生移动时,平衡常数K值一定增大
B. HS-的电离方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 由水电离出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的离子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液与Na2CO3溶液混合发生反应:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,NaCN溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如下图甲所示。
向10 mL 0.01 mol·L-1 NaCN溶液中逐滴加入0.01 mol·L-1的盐酸,其pH变化曲线如下图乙所示[其中a点的坐标为(9.5,0.5)]。

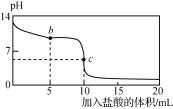
甲 乙
下列溶液中的关系中一定正确的是
A. 图甲中pH=7的溶液:c(Cl-)=c(HCN)
B. 常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol/L
C. 图乙中b点的溶液:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D. 图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
查看答案和解析>>
科目: 来源: 题型:
【题目】一种特殊的热激活电池示意图如下。该电池总反应为:PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ,下列说法不正确的是

A. Ca电极发生氧化反应
B. 负极的电极反应:Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s)
C. 可用 LiCl 和 KCl 水溶液代替无水 LiCl﹣KCl
D. 当无水LiCl﹣KCl混合物受热熔融后电池才能工作
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L己烷中含有分子数目为NA
B. 1mol/LNaOH溶液中含有Na+数目为NA
C. 7.8gNa2O2中含有的共价键数目为0.1NA
D. 将0.5molN2O4充入密闭容器中充分反应转化成NO2的数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】桂皮酸是从肉桂皮中分离出的有机酸,广泛应用于精细化工品的生产。桂皮酸的一条成路线如下,部分需要的试剂或条件略去:

已知:

(1)D中官能团名称为___________________,反应IV的反应类型为______________________。
(2)写出反应I的化学方程式__________________________________________
(3)写出桂皮酸的结构简式____________________________________________
(4)为检验D是否已经完全转化为桂皮酸,所用试剂和实验条件是_________________________。
(5)写出同时满足下列三个条件的C的同分异构体的结构简式__________________
①属于芳香族化合物 ②核磁共振氢谱为四组峰 ③能与 NaHCO3溶液反应产生气体
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铜(Cu)、砷(As)、镓(Ga)等形成的化合物在现代工业中有广泛的用途,回答下列问题:
(1)基态铜原子的价电子排布式为_____________,价电子中未成对电子占据原子轨道的形状是__________________________。
(2)化合物AsCl3分子的立体构型为________________,其中As的杂化轨道类型为_____________。
(3)第一电离能Ga__________As。(填“>”或“<”)
(4)若将络合离子[Cu(CN)4]2-中的2个CN- 换为两个Cl-,只有一种结构,则[Cu(CN-)4]2-中4个氮原子所处空间构型为_______________,一个CN-中有__________个π键。
(5)砷化镓是一种重要的半导体材料,晶胞结构如图所示。

熔点为1238℃,密度为g·cm-3,该晶体类型为______________,Ga与As以__________键键合,Ga和As的相对原子质量分别为Ma和Mb,原子半径分别为racm和rbcm,阿伏加德罗常数值为NA,GaAs晶胞中原子体积占晶胞体积的百分率为____________________。(列出计算公式)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com