
科目: 来源: 题型:
【题目】海洋是一个巨大的宝藏,期待着人们的开发和利用。
Ⅰ.(1)利用海水可以得到食盐,从海水中得到食盐的变化是___变化。(填“物理”或“化学”)
(2)要除去某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
A.蒸发结晶 B.过滤 C.加入过量的Na2CO3溶液 D.加水溶解 E.加入过量的烧碱溶液 F.加入过量稀盐酸 G.加入过量的Ba(NO3)2溶液 H.加入过量的稀硝酸 I.加入过量的BaCl2溶液
正确的操作顺序是:__→E→___→C→__→__→A
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示:

(1)指出提取碘的过程中有关的实验操作名称:①___③___。
(2)操作③中可以选择的有机试剂为___,选择该试剂时,水层在___层(填 “上”或“下”),含碘溶液应从___(获得填“容器上口”或“容器下口”),要从碘的有机溶液中获得碘单质,应采用___的操作(填一种实验操作方法)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乳酸乙酯( )是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
)是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
A. 8种B. 9种C. 10种D. 12种
查看答案和解析>>
科目: 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。请回答下列问题:
(1)钴在元素周期表中的位置是___________,其基态原子的价电子排布图为___________。
(2)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为________。
),则CO32-中的大π键应表示为________。
(3)已知Fe2+半径为61pm,Co2+半径为65pm,在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。则该配合物的配位数为_____。
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构(如图所示),则该晶体中与铁原子距离最近的铁原子数目为___________;若该晶胞参数为a pm,则该晶体的密度为___________g·cm-3(阿伏加德罗常数的值用NA表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】现有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Ba2+、CO32-、Cl-、SO42-。现取两份200mL溶液分别进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体1.36g;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,以下推测正确的是( )
A.一定存在NH4+、CO32-、SO42-,一定不存在Ba2+、Cl-
B.一定存在NH4+、CO32-、Cl-、SO42-,可能存在K+
C.c(SO42-)=0.2mol/L,c(NH4+)>c(SO42-)
D.若溶液中存在K+、NH4+、CO32-、Cl-、SO42-五种离子,则c(K+)>0.2mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.A,B,C分别代表三种不同的短周期元素,A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍。
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于__键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是__;
(2)当n=2时,B与C形成的晶体属于__晶体,当n=3时,B与C形成的晶体中,B原子的杂化方式为__,微粒间的作用力是__;
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物。
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4],CO分子中C原子上有一对孤对电子,C,O原子都符合8电子稳定结构,CO的结构式为__,与CO互为等电子体的离子为__(填化学式)。
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,镓的基态原子的电子排布式是_______________,Ga的第一电离能却明显低于Zn,原因是_____________________。
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是__。
a.直线形;三角锥形 b.V形;三角锥形 c.直线形;平面三角形 d.V形;平面三角形
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式,书写正确的是( )
A.硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓
B.盐酸与碳酸钡反应:CO32-+2H+=CO2↑+H2O
C.硝酸银溶液中加入铜粉:Ag++Cu=Cu2++Ag↓
D.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
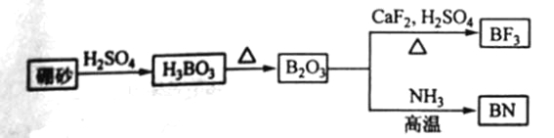
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
B.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
C.在常温常压下,11.2LCl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:

已知:滤渣2中除了过量的MgO外,还含有Fe(OH)3。
(1)酸溶时,MgCO3与稀硫酸反应的离子方程式为__________。
(2)滤渣1的化学式为__________________。
(3)流程中“氧化”的氧化剂是:_________,写出该流程的离子方程式为______________。
(4)高温煅烧过程中,同时存在以下反应:2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。
MgO+SO2↑+CO↑;MgSO4+3C高温MgO+S↑+3CO↑。利用下图装置对煅烧产生的气体进行连续分别吸收或收集(其中S蒸气在A管中沉积)。

①D中收集的气体是_________________(填化学式)。
②B中盛放的溶液是__________________(填下列选项的字母编号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com