
科目: 来源: 题型:
【题目】二环[1,1,0]丁烷(![]() )是最简单的桥环化合物。下列关于该化合物的说法错误的是
)是最简单的桥环化合物。下列关于该化合物的说法错误的是
A. 该化合物的二溴代物有4种
B. 每1mol该化合物反应生成1molC4H10需要2molH2
C. 该化合物能够发生取代反应和氧化反应
D. 该化合物中4个碳原子可能处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是

A. X电极连接电源负极
B. N为阳离子交换膜
C. Y电极反应式为 O2+2H2O+4e-=4OH-
D. 制备2.4g LiOH产生的H2在标准状况下为2.24 L
查看答案和解析>>
科目: 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因 。
(2)在恒温条件下,1 mol NO2和足量C发生反应:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
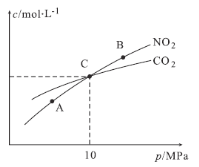
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp= (列出表达式并计算结果。Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)亚硝酸的电离平衡常数Ka=5.1×10-4(298K)。它的性质和硝酸很类似。
①已知298K 时,H2CO的Ka1=4.2×10-7 ;Ka2=5.61×10-11。向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
②将10mL0.1mol/L的亚硝酸溶液加入到10mL0.1mol/L氨水(已知在25℃时,一水合氨的Ki= 1.8×10-5)中,最后所得溶液为________(填“酸性”、“碱性”或者“中性”)。
(4)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+ 4CO(g)![]() CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
(5)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。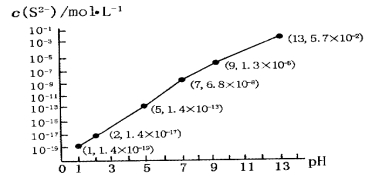
①pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
②某溶液含0.010 mol·L-1Fe2+和0.10 mol·L-1H2S,当溶液pH=______时,Fe2+开始沉淀。【已知:KSP(FeS)=1.4×10-19】
查看答案和解析>>
科目: 来源: 题型:
【题目】某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ②mg该硫原子的物质的量为
②mg该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNA g ④ag该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 生成乙烯的速率:v(N)一定大于v(M) B. 该反应的逆反应为吸热反应
C. 平衡常数:KM>KN D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。下列有关说法不正确的是
A. 制冷剂氟里昂-12(CCl2F2)的研发利用,充分体现了元素周期表的指导作用
B. 通过测定物质中![]() 的含量可以推断文物的年代
的含量可以推断文物的年代
C. 门捷列夫预言的“类铝” 镓(Ga)元素的发现,证实了元素周期律的科学性
D. 过渡元素Ti、Mo、W等的单质有耐高温,耐腐蚀的特点,其合金可以制造火箭、导弹、宇宙飞船等
查看答案和解析>>
科目: 来源: 题型:
【题目】
以芳香烃A为原料制备某重要医药中间体F的合成路线如下:
![]()
试回答下列问题:
(1)B的化学名称为___________。
(2)F中所含官能团的名称为___________。
(3)由A生成B和由D生成E的反应类型分别是___________、___________。
(4)已知G的分子式为C4H9Br2N,在一定条件下C与G反应生成 ,写出该反应的化学方程式___________。
,写出该反应的化学方程式___________。
(5)写出同时满足下列条件的D的两种同分异构体的结构简式___________、___________。
①含有苯环,且分子中含有4种不同化学环境的氢;
②既能与盐酸反应,又能发生银镜反应。
(6)请以![]() 、(CH3)2SO4、CH3CH2OH为原料,结合本题信息和流程图中的图例,写出制备
、(CH3)2SO4、CH3CH2OH为原料,结合本题信息和流程图中的图例,写出制备![]() 的合成路线流程图(其它无机试剂任选)。
的合成路线流程图(其它无机试剂任选)。
_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于分散系的叙述不正确的是
A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D. 如图所示是树林中的晨曙,该反应与丁达尔效应有关
查看答案和解析>>
科目: 来源: 题型:
【题目】
新型储氢材料是氢能的重要研究方向。
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。
①基态O原子的电子占据了___________个能层,最高能级有___________种运动状态不同的电子。
②CH4、H2O、CO2分子键角从大到小的顺序是___________。生成物H3BNH3中是否存在配位键___________(填“是”或“否”)。
(2)掺杂T基催化剂的NaAlH4是其中一种具有较好吸、放氢性能的可逆储氢材料。NaAlH4由Na+和AlH4-构成,与AlH4-互为等电子体的分子有____(任写一个),Al原子的杂化轨道类型是____。Na、Al、H元素的电负性由大到小的顺序为_____。
(3)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为___________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg/cm3。设NA为阿伏加徳罗常数的值,则该晶胞的体积是___________cm3(用含M、d、NA的代数式表示)。
③已知晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较温定,晶胞参数分别为apm、apm、cpm。标准状况下氢气的密度为Mg/cm3;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________。(用相关字母表示已知储氢能力=![]() )。
)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质本身的是( )
①CuSO4;②KHCO3;③FeSO4;④NH4Cl;⑤MgSO4;⑥AlCl3 ;
A. ①③ B. ①⑤ C. ①③⑤ D. ①②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com