
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 17g H2O2中含有非极性键的数目为NA
B. 常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
D. 13. 8g NO2与足量水反应,转移的电子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物A是一种重要的化工原料,合成路线如下:
 已知以下信息:
已知以下信息:
①
② R—CH===CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③核磁共振氢谱显示A有2种不同化学环境的氢。
(1)A 的名称是________。F的结构简式为________。
(2)A―→B的反应类型为________。I中存在的含氧官能团的名称是________。
(3)写出下列反应的化学方程式。
D―→E:__________。
(4)I的同系物J比I相对分子质量小28,J的同分异构体中能同时满足如下条件的共有________种(不考虑立体异构)。
①苯环上只有两个取代基;②既含-CHO,又能和饱和NaHCO3溶液反应放出CO2
(5)参照上述合成路线,以 为原料(无机试剂任选),设计制备苯乙酸(
为原料(无机试剂任选),设计制备苯乙酸(![]() )的合成路线:__________________________
)的合成路线:__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】铁触媒是重要的催化剂,铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一。CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5;在溶液中除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3 = 刹[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]___;C、N、O的电负性由大到小的顺序为______。
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为______;配合物[Cu(NH3)2]OOCCH3中,铜显___价,碳原子的杂化轨道类型是______,NH3价电子对互斥理论模型是______。
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有________(填字母)形成。
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________。
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为________(写出已化简的比例式即可)。(两种堆积中最邻近的铁原子的核间距相等)

查看答案和解析>>
科目: 来源: 题型:
【题目】以含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料的碳一化学处于未来化学产业的核心,成为科学家研究的重要课题。
(1))已知CO、H2、CH3OH(g)的燃烧热分别为-283.0 kJ·mol-1、-285.8 kJ·mol-1、-764.5 kJ·mol-1。则反应Ⅰ:CO(g)+2H2(g)![]() CH3OH(g) ΔH=_____;。
CH3OH(g) ΔH=_____;。
(2)在T1时,向体积为2 L的恒容容器中充入物质的量之和为3 mol的CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。
CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与n(H2)/n(CO)的关系如图所示。
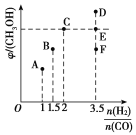
①当起始n(H2)/n(CO)=2时,经过5 min达到平衡,CO的转化率为0.6,则0~5 min内平均反应速率v(H2)=______。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4 mol,达到新平衡时H2的转化率将____(填“增大”“减小”或“不变”)。
②当n(H2)/n(CO)=3.5时,达到平衡后,CH3OH的体积分数可能是图像中的________(填“D”“E”或“F”)点。
(3)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率(α)与温度(T)、压强(p)的关系如图所示。
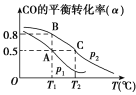
①A、B、C三点的平衡常数KA、KB、KC的大小关系为________。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为_____L。
(4)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图所示。则电源的负极为__(填“A”或“B”),写出阳极的电极反应式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用NaOH固体配制240mL 1.2mol/L的NaOH溶液,填空请回答下列问题:
(1)配制240mL 1.2mol/L的NaOH溶液
应称取NaOH的质量/g | 选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
_________ | ________ | _______ |
(2)容量瓶上需标有以下五项中的_____________________;
①浓度 ② 温度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___;
A.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
B.用天平准确称取所需的NaOH的质量,加入少量水,用玻璃棒慢慢搅动,使其充分溶解
C.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G 装入贴好标签的试剂瓶待用
(4)下列配制的溶液浓度偏低的是__;
A.称量NaOH时,在滤纸上称量
B.配制前,容量瓶中有少量蒸馏水
C.加蒸馏水时不慎超过了刻度线
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E 容量瓶在使用前烘干
查看答案和解析>>
科目: 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其中含Fe、Ca、Mg、Al等元素。
②Al3+、Fe3+沉淀完全的pH分别为4.7、3.2,Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③焙烧过程中主要反应为MnCO3+2NH4Cl ![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
(1)结合图1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(菱锰矿粉)分别为____________、____________、____________。

(2)对浸出液净化除杂时,需先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围__,将Fe3+和Al3+变为沉淀而除去,然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(3)“碳化结晶”步骤中,加入碳酸氢铵时反应的离子方程式为____。
(4)上述流程中可循环使用的物质是________。
(5)现用滴定法测定浸出液中Mn2+的含量。实验步骤:称取1.000 g试样,向其中加入稍过量的磷酸和硝酸,加热使反应2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
2[Mn(PO4)2]3-+NO2-+H2O充分进行并除去多余的硝酸;加入稍过量的硫酸铵,发生反应NO2-+NH4+===N2↑+2H2O以除去NO2-;加入稀硫酸酸化,用2.00 mol·L-110.00 mL硫酸亚铁铵标准溶液进行滴定,发生的反应为[Mn(PO4)2]3-+Fe2+===Mn2++Fe3++2PO43-;用0.10 mol·L-110.00 mL酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应(还原产物是Cr3+)的离子方程式为___________。
②试样中锰的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到目的是
A. 用PH试纸测定次氯酸溶液的pH
B. 将FeCl3溶液加热蒸干并灼烧获得Fe2O3固体
C. 向明矾溶液中加入一定量NaOH,制备Al(OH)3胶体
D. 室温下,测得pH=5的NaHSO4溶液与pH=9的NaHCO3溶液中水的电离程度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com