
科目: 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
已知:C(s)+2H2(g) = CH4(g) ΔH= -76 kJ·mol1
C(s)+O2(g) = CO2(g) ΔH= -394 kJ·mol1
2C(s)+ O2(g) =2 CO(g) ΔH= -222 kJ·mol1
该催化重整反应的ΔH=______kJ·mol1,有利于提高CH4平衡转化率的条件是(填标号)。______________
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应: CH4(g) | 消碳反应: CO2(g)+C(s) | ||
ΔH/(kJ·mol1) | +75 | +172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①上表判断,催化剂X_______Y(填“优于”或“劣于”),理由是:____________。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的 变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(υ)的叙述正确的是________填标号)。

A.K积、K消均增加
B.υ积减小,υ消增加
C.K积减小,K消增加
D.υ消增加的倍数比υ积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为υ=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为____。

查看答案和解析>>
科目: 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(g) H1
CO(g)+H2O(g)===CO2(g)+H2(g) H2
2CO(g)+O2(g)===2CO2(g) H3
则CO2(g)+CH4(g)===2CO(g)+2H2(g)的H=____________。
(2)天然气中的少量H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式_________________。
(3)用盐酸作甲醇燃料电池的电解质正在成为热点课题。甲醇可以用一氧化碳与氢气反应生成(催化剂为Cu2O/ZnO)。已知:2CO(g) +O2(g) ![]() 2CO2(g) △H = -566 kJ mol-1
2CO2(g) △H = -566 kJ mol-1
CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g) +2H2(g) △H = -182.9 kJ mol-1
CO2(g) +2H2(g) △H = -182.9 kJ mol-1
则 CO(g) +2H2(g) ![]() CH3OH(g) △H = ______。
CH3OH(g) △H = ______。
若将生成的CH3OH与盐酸、氧气构成燃料电池,则燃料电池的负极反应式为__________。
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为l06,其核磁共振氢谱如图2所示,则X的结构简式为_________。

(5)科学家用氮化镓材料与铜组装如右图所示人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。

①写出铜电极表面的电极反应式_________。
②为提高该人工光合系统的工作效率,可向装置中加入少量_______(选填“盐酸”或“硫酸”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:

已知0.010 mol/L金属离子在不同pH下的沉淀情况如下:
Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是___________________,“沉渣2”的主要成分是_____,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________。
(2)用离子方程式解释加入NH4F “除Ca”的过程________________。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3:2,此时Ni单质所发生的化学方程式为_______。
(4)“操作X”是________、________
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为__________________。
(6)根据上表数据,计算当0.010 mol/L NiSO4溶液中Ni2+完全沉淀时的c(Ni2+)= ____mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠广泛用于工业、建筑业及食品加工业。某课外活动小组的同学拟制备亚硝酸钠、测定其产品的纯度并验证亚硝酸钠的某些性质。
(1)甲组同学采用下图装置制取亚硝酸钠。

①仪器M的名称是______________。
②装置A中用较浓的硫酸而不用稀硫酸的原因是_____________________。
③若装置B中生成等物质的量的NO与NO2,则装置B中发生反应的离子方程式为______。
④已知NO与NaOH溶液不反应,而NO2可与NaOH溶液发生反应:2NO2+2NaOH ![]() NaNO3+NaNO2+H2O。若通入装置C中的NO与NO2物质的量之比为1 :1,则装置C中发生反应的化学方程式为_______。
NaNO3+NaNO2+H2O。若通入装置C中的NO与NO2物质的量之比为1 :1,则装置C中发生反应的化学方程式为_______。
(2)乙组同学拟测定甲组制得的产品中NaNO2的纯度。乙组同学采用高锰酸钾滴定法,称取m g试样于锥形瓶中,加入适量水溶解,然后用c mol·L-1的KMnO4溶液(适量稀H2SO4酸化)进行滴定,并重复上述操作2次。
①高锰酸钾溶液应盛放在___________(填“酸式”或“碱式”)滴定管中。
②滴定至终点时溶液的颜色变化是__________________。
③若滴定至终点时平均消耗VmL标准溶液,则产品的纯度为_____(用含c、m、V的代数式表示)。
(3)丙组同学拟设计实验证明:
①酸性条件下NaNO2具有氧化性。实验操作为________________________。
②HNO2的酸性比CH3COOH强。实验操作为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A为一氯代物,H是通过缩聚反应获得的高聚物。

已知:![]() (苯胺,易被氧化)
(苯胺,易被氧化)
(1)X的结构简式为 。
(2)A的结构简式为 。
(3) G的结构简式为 。反应②③两步能否互换 ,(填“能”或“不能”)理由是 。
(4)反应④的化学方程式是 ;反应⑤的化学方程式是 。
(5)写出同时满足下列条件的阿司匹林的一种同分异构体的结构简式 。
①苯环上一卤代物只有2种;
②能发生银镜反应,分子中无甲基;
③1mol该物质最多能与3molNaOH反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学上常用AG表示溶液中的酸碱度,AG=lg![]() 。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是
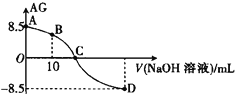
A. B点溶液中存在2c(H+)-2c(OH-)=c(A-)-c(HA)
B. C点时,加入NaOH溶液的体积大于20.00 mL
C. 滴定过程中应该选择甲基橙做指示剂
D. 25℃时,该酸HA的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目: 来源: 题型:
【题目】将 0.2mol MnO2和 50mL 12molL﹣1浓盐酸混合后缓缓加热,反应完全后,再向溶液中加入足量 AgNO3溶液,生成 AgCl 沉淀的物质的量为(不考虑盐酸的挥发)( )
A. 大于 0.3 mol,小于 0.6 mol B. 等于 0.3 mol
C. 小于 0.3 mol D. 大于 0.6 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物经燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和-C≡C-H,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是 。
(2)下列物质中,一定条件下能与A发生反应的是 。
a.H2 b.Na c.酸性KMnO4溶液 d.Br2
(3)A的结构简式是 。
(4)有机物B是A的同分异构体,能发生银镜反应,1 mol B最多能与2 mol H2加成。B中所有碳原子一定处于同一个平面,请写出所有符合条件的B的结构简式(不考虑立体异构) 、 。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】1,2二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用图9所示装置制备1,2二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:

(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式 ;该反应类型为 。
(2)写出制备1,2二溴乙烷的化学方程式 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(4)容器c中NaOH溶液的作用是 ;e装置内NaOH溶液的作用是 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com