
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 新制的氯水在光照条件下颜色变浅
B. 合成氨工业中使用铁触媒作催化剂
C. 红棕色的NO2气体,加压后颜色先变深后变浅
D. 工业生产硫酸的过程中,通入过量的空气以提高二氧化硫的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】FeS、FeS2在酸性条件下都能与重铬酸钾(K2Cr2O7)溶液反应,还原产物为Cr3+,氧化产物都是Fe3+、SO42-。等物质的量FeS、FeS2完全反应时,消耗氧化剂的物质的量之比为
A.5:3B.9:17C.3:5D.3:4
查看答案和解析>>
科目: 来源: 题型:
【题目】I.常温下将0.1 mol NH4Cl和0.02 mol NaOH溶于水配成1 L溶液。
(1)该溶液中存在的平衡体系有(用离子方程式表示)________
(2)此溶液中共有________ 种离子。
(3)这些离子中浓度为0.1mol/L的是___,浓度为0.02mol/L的离子是___。
(4)____和_____两种微粒的物质的量之和比OH-的物质的量多0.08 mol。
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质中最适宜采用的是________(填选项字母)
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列物质中的______(填选项字母)
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则:该温度下水的离子积常数Kw=________,在该温度下,将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,溶液的pH=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物J是一种消炎镇痛药,下图为J的合成路线(部分产物和反应条件省略):
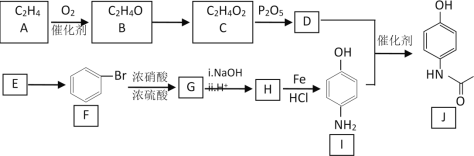
已知部分信息如下:
①![]() (此类物质易与水、酸等反应)
(此类物质易与水、酸等反应)
②![]()
回答下列问题:
(1)A中官能团的名称是_________,D + I→J的反应类型为___________。
(2)反应B→C的化学方程式为__________________。
(3)E→F的反应条件为___________,在质谱仪上E的最大质荷比为________。
(4)J有多种同分异构体,其中满足下列条件,且苯环上一氯代物只有两种的异构体的结构简式为________________。
a.氨基(–NH2)与苯环直接相连;b.能发生银镜反应;c.能发生水解反应
(5)证明G已部分生成H的实验方案是__________________。
(6)参照上述流程,设计以  为原料,制备
为原料,制备 的合成路线(无机试剂任选)。_______________________________。
的合成路线(无机试剂任选)。_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A. MnS的![]() 比CuS的
比CuS的![]() 大
大
B. 该反应达到平衡时:![]()
C. 往平衡体系中加入少量![]() 固体后,
固体后,![]() 变大
变大
D. ![]() 的浊液中加入少量可溶性
的浊液中加入少量可溶性![]() 固体后,
固体后,![]() 变大
变大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知水的电离方程式:H2O![]() H++OH-。下列叙述中,正确的是
H++OH-。下列叙述中,正确的是
A. 升高温度,Kw增大,pH不变
B. 向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C. 向水中加入少量硫酸,c(H+)增大,Kw不变
D. 向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目: 来源: 题型:
【题目】祖母绿是四大名贵宝石之一,主要成分为Be3Al2Si6O18,含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)基态Ni2+的电子排布式为_______________;宝石中Si的杂化方式是____。
(2)成键元素电负性差值越大,化学键离子性百分数越高,在卤素与Al组成的化合物中,离子性百分数最高的化合物是______(填化学式)。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是______,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的作用力类型为_________。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用Δ表示),它与中心离子的结构、电荷、配体有关。试判断分裂能Δ[Fe(H2O)63+] _____ Δ[Fe(H2O)62+](填“>”“<”或“=”),理由是___________________________。
(5)①氧化镍晶胞如图甲所示,A的原子坐标参数为:(0,0,![]() ),则底面面心B的原子坐标参数为_______________。
),则底面面心B的原子坐标参数为_______________。

②按图乙所示无限拓宽延长,NiO可形成“单层分子”,氧离子和镍离子均看着球体,其半径分别为a pm、b pm,“单层分子”截割出的最小重复结构单元在空间呈长方体,则离子在长方体内的空间利用率为____________(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是( )
A. v(N2)=0.05 mol·L-1·s-1 B. v(H2)=0.3 mol·L-1·min-1
C. v(N2)=0.2 mol·L-1·min-1 D. v(NH3)=0.3 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应mX(g)+nY(g)qZ(g),△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列有关说法正确的是( )
A. 如果继续通入一定量某气体使体系压强增大,平衡将正向移动
B. 此时,X的正反应速率是Y的逆反应速率的π/n倍
C. 如果降低温度,且保持物质状态不发生改变,混合气体的平均相对分子质量变小
D. 如果增加X的物质的量,平衡正向移动,X的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是造成全球气候变暖的主要气体,同时也是一种来源丰富、价格低廉的碳资源。中科院福建物构所谢奎及其团队利用电能将CO2高效转化为CO,CO和H2可生产优质燃料和多种化工产品,实现碳资源的循环利用。
(1)已知反应过程中能量变化如下表和曲线图所示:
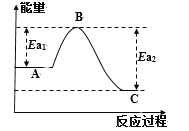
反应 | A | C | Ea1(kJ/mol) | Ea2(kJ/mol) | ΔH(kJ/mol) |
① | 2CO(g)+O2(g) | 2CO2(g) | ? | 2389 | -566 |
② | 2H2(g)+O2(g) | 2H2O(l) | 1480 | ? | -571.6 |
③ | 2CH3OH(l)+3O2(g) | 2CO2(g)+4H2O(l) | 3026 | 4478 | ΔH3 |
反应③ 的ΔH3=_________kJ/mol。
CO(g) + 2H2(g) ![]() CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
CH3OH(l) ΔH4=_______kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______(填字母)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在不同的电压下,CO2、H2O混合电解转化为CO、H2的电流效率如图所示(注:电流效率![]() ×100%):
×100%):
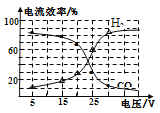
①由图可知生成CO和H2有相互/span>_______(填“促进”、“抑制”或“无影响”)作用。
②用此法生产的CO和H2合成CH3OH,为使CO和H2利用率最高,电解时应控制电压在________ V左右(选填5、15、23、25、30)。
(3)在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,在恒温恒容下发生反应CO(g) + 2H2(g) ![]() CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
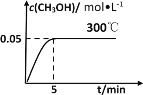
①图中判断反应到达平衡状态的依据是________________。
② 5min内H2的平均反应速率v(H2) =________mol/(Lmin)。
③ 若在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时反应将_______(填字母)。
A.正反应方向反应 B.逆反应方向反应
C.达到平衡 D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com