
科目: 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____。
(2)乙池中 A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为__________。
(3)当乙池中 B 极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状 况),丙池中_____(填“C”或“D”)极析出_____g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,开关闭合一段时间后,甲中溶液的 pH将_____(填“增大”“减小”或“不变”,下同),丙中溶液的 pH 将______。
查看答案和解析>>
科目: 来源: 题型:
【题目】用惰性电极电解一定浓度的 CuSO4 溶液一段时间后,欲使溶液恰好恢复至电解前情况,需加入的物质是
A. CuSO4 B. Cu C. CuCO3 D. Cu2O
查看答案和解析>>
科目: 来源: 题型:
【题目】2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于![]() Pt的说法正确的是( )
Pt的说法正确的是( )
A.![]() Pt和
Pt和![]() Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B.![]() Pt和
Pt和![]() Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C.![]() Pt和
Pt和![]() Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D.![]() Pt和
Pt和![]() Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、氯、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题。
(1)二氧化氯(ClO2)已逐步代替Cl2用于自来水处理,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。已知:25 ℃时Ka(HClO)=3.2×10-8,Ka(HClO2)=1.0×10-2,则酸性HClO2________HClO(填“>”“=”或“<”);在pH=5的上述处理过的饮用水中![]() =___________;若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,写出酸性条件下该反应的离子方程式:____________________________________________________________。
=___________;若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,写出酸性条件下该反应的离子方程式:____________________________________________________________。
(2)①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,下图为金属离子的浓度的对数与溶液pH的关系,现向混合溶液中通入氨气调节溶液的pH=5.6,溶液中存在的金属阳离子为____________(当溶液中金属离子浓度≤10-5mol·L-1时,可认为沉淀完全)。

②从图中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=______________________。
(3)Na2S是常用的重金属离子沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+,滴加Na2S溶液后首先析出的沉淀是________________;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-1),此时的S2-浓度为___________________________。已知:Ksp(FeS)=6.3×10-18;Ksp(CuS)=6×10-36;Ksp(PbS)=2.4×10-18。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
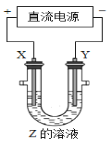
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 钢铁在潮湿的空气中容易生锈
B. 开启啤酒后,瓶中马上泛起大量泡沫
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率(2SO2+O2![]() 2SO3)
2SO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中, 采用废易拉罐(主要成分为 Al,含有少量的 Fe、Mg 杂质)制备明矾的过程如下图所示。 回答下列问题:
![]()
(1)为尽量少引入杂质,试剂①应选用______________(填标号)。
a.HCl 溶液 b.H2SO4 溶液 c.氨水 d.NaOH 溶液
(2)易拉罐溶解过程中主要反应的化学方程式为_________________________。
(3)沉淀 B 的化学式为______________________
II.毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O 的流程如下:

(4)毒重石用盐酸浸取前需充分研磨,目的是_________________________________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(5)滤渣Ⅱ中含 (填化学式)。加入 H2C2O4 时应避免过量,原因是_________________________________。已知:Ksp(BaC2O4) =1.6×10-7, Ksp(CaC2O4)=2.3×10-9
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,Ksp(Ag2SO4)=2.0×10-5。取适量Ag2SO4溶于蒸馏水得到200 mL饱和溶液,在该饱和溶液中c(SO42-)=0.017 mol·L-1。向该饱和溶液中加入0.020 mol·L-1 Na2SO4溶液200 mL,得到溶液R。(不考虑混合后溶液体积的变化)下列说法正确的是( )
A.R中c(Ag+)=2c(SO42-)
B.得到溶液R的过程中会产生沉淀
C.R中c(Ag+)=0.017 mol·L-1
D.加入Na2SO4溶液促进沉淀溶解平衡向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com