
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 常温下,在0.1mol·L-1的HNO3溶液中,由水电离出的c(H+)<![]()
B. 浓度为0.1mol·L-1的NaHCO3溶液:c(H2CO3)>c(CO32-)
C. 25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D. 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )

A.甲池中负极反应为:N2H4﹣4e﹣═N2+4H+
B.甲池溶液pH不变,乙池溶液pH减小
C.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗2.24L O2,此时乙池中理论上最多产生12.8g固体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是 ( )

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图3,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO,调节pH=4,过滤
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学:选修5:有机化学基础)以有机物A制备高分子化合物F( )的流程如下:
)的流程如下:

请回答下列问题。
(1)A的官能团名称是_______;C的系统命名是____________。
(2)①的反应类型是_______,⑤的反应类型是___________。
(3)写出反应③的化学方程式:______________________。
(4)满足下列条件的B同分异构体有____种。
Ⅰ.能与Na反应产生气体 Ⅱ.能与NaOH 反应 Ⅲ.不能与Na2CO3反应。
若与NaOH溶液反应的有机物中的碳原子数目为2,则其结构简式是__________。
(5)已知:
Ⅰ. ![]()
Ⅱ. 
写出以CH2=CHCH=CH2为原料制备C的合成路线流程图(无机试剂可以任选):__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NO2是大气污染物之一,实验室拟用NO2与Cl2混合用NaOH溶液吸收的方法消除其污染。回答下列问题:
(1)氯气的制备
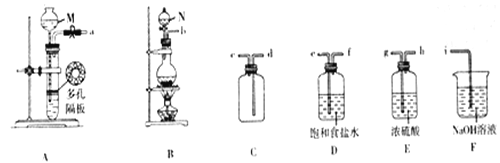
①仪器M、N的名称依次是_______________。
②欲用MnO2和浓盐酸制备并收集一瓶纯净干燥的氯气,选呢上图中的装置,其连接顺序为____(按气流方向,用小写字母表示)。
③D在制备装置中的作用是___________;用离子方程式表示装置F的作用是_________________。
(2)用如图所示装置探究Cl2和NO2在NaOH溶液中的反应。查阅有关资料可知:HNO2是一种弱酸,且不稳定,易分解生成NO和NO2。

①装置中X和Z的作用是______________
②实验时观察到X试剂瓶中有黄绿色气体,Z试剂瓶中有红棕色气体,若通入适当比例的Cl2和NO2,Y中观察不到气体颜色,反应结束后加入稀硫酸无现象,则Y中发生反应的化学方程式是________。
③反应结束后,取Y中溶液少许于试管中,加入稀硫酸,若有红棕色气体产生,解释产生该现象的原因:_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为______;价电子中成对电子数有____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是_________。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___H3PO4(填“>”或“<”),从结构的角度说明理由:__________________________。
(3)磷青铜中的锡、磷两元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
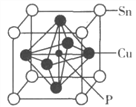
①则其化学式为________。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为_________。
③若晶体密度为8.82g·cm-3,最近的Cu原子核间距为____pm(用含NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为
N2(g)+3H2(g)![]() 2NH3(g) △H。
2NH3(g) △H。
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
则△H=_____________。
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将_________(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是________,其原因是__________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)______ vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=___(保留一位小数)。
(4)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s) ![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)。
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是_____(填序号)。
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】Ni2O3主要用作陶瓷、搪瓷和玻璃的着色剂,也可用于镍粉的制造。以镍粉废料为原料制备Ni2O3的工艺如下:
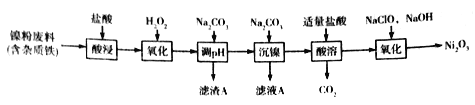
回答下列问题:
(1)Ni2O3中Ni的化合价为_________。
(2)提高“酸浸”、“酸溶”速率时,温度不宜过高,其原因是__________。
(3)加入H2O2“氧化”的离子方程式为_____________;滤渣A的主要成分是________(填化学式)。
(4)工艺中分步加入Na2CO3的作用是________;为提高原料的利用率,应控制加入NaClO与NaOH的物质的量之比为_________。
(5)工业上,用镍为阳极,电解0.1mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率(电流效率是指电解时,在电极上实际沉积的物质的量与理论析出量之比)及镍的成粉率的影响如图所示:
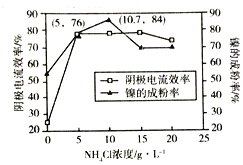
①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为______mol/L.
②当NH4Cl溶液的浓度大于15g/L时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某酸HA的电离常数Ka=2.0×10-8,用2mol/LNaOH溶液滴定100ml2mol/LHA溶液,溶液的pH随滴入NaOH溶液的体积变化曲线如图![]() 下列说法正确的是
下列说法正确的是

A. a点溶液的pH=4
B. b点溶液中存在:c(A-)>c(Na+)>c(H+)=c(OH-)
C. b点c(HA)/c(A-)=5
D. c点c(A-)+c(H+)=c(Na+)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】新型夹心层石墨烯锂硫二次电池的工作原理可表示为16Li+xS8![]() 8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是
8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是
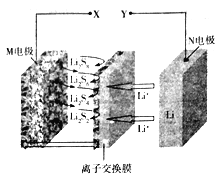
A. 电池充电时X为电源负极
B. 放电时,正极上可发生反应:2Li++Li2S4+2e-=2Li2S2
C. 充电时,没生成1molS8转移0.2mol电子
D. 离子交换膜只能通过阳离子,并防止电子通过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com