
科目: 来源: 题型:
【题目】常温下,向l L pH=l0的NaOH溶液中持续通入CO2。通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示。下列叙述错误的是
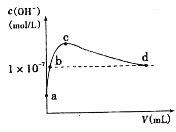
A. a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
B. b点溶液中:c(H+)=1×10-7mol·L-1
C. c点溶液中:c(Na+)>c(HCO3-)>c(CO32-)
D. d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断不正确的是( )

A. 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大
B. 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大
C. 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol·L-1·min-1
D. 50min时,pH=2和pH=7时R的降解百分率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 共价化合物的熔沸点都比较低
B. ![]() 、
、![]() 、
、![]() 三种核素可组成3种水分子
三种核素可组成3种水分子
C. H2O分子比H2S分子稳定的原因,是H2O分子间存在氢键
D. SiO2和CaCO3在高温下反应生成CO2气体,说明硅酸的酸性比碳酸强
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、 NH4+、H+、 N2、Cl-六种微粒。其中ClO-的物质的量随时间变化的曲线如图所示。下列判断正确的是( )

A. 该反应的还原剂是Cl- B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6 mol电子 D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. lmol葡萄糖能水解生成2molCH3CH2OH和2molCO2
B. 苯的结构简式为![]() ,能使酸性高锰酸钾溶液褪色
,能使酸性高锰酸钾溶液褪色
C. 相同物质的量的乙烯与乙醇分别在足量的O2中完全燃烧,消耗O2的物质的量相同
D. 乙烯和植物油都能使溴水褪色,其褪色原理不同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式不正确的是( )
A. 氯气和水反应:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. 铁与稀盐酸反应:Fe+2H+=Fe2++H2↑
C. 碳酸氢铵溶液与足量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D. 少量二氧化硫气体通入FeCl3溶液中:2Fe3++SO2+2H2O=2Fe2++4H++SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】H、N、O、Na、S、Cl都是中学化学中的常见元素,根据题意回答与这些元素有关的问题:
(1)画出Na原子结构示意图_______,Na2O2可用作供氧剂,其电子式为_______。
(2)Cl2是一种大气污染物,装有液氯的钢瓶上应贴的标签是_______(填编号)。

氯气泄漏可用NaHSO3溶液来处理,写出相关的离子反应方程式_____________。
(3)25C时,利用pH试纸测得0.1mol/L氨水的pH约为11,则可以估算出氨水的电离常数约为_____;向10mL此溶液中通入少量氨气,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
(4)有两种化合物同时含有上述六元素中的四种元素。将这两种化合物的溶液混合后,恰好完全反应,生成物之一M仍含有这四种元素,该反应的离子方程式为______________。若M溶液的pH =5,则由水电离出的c(H+)=_______mol/L,该溶液离子浓度由大到小的顺序为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是一种重要的工业原料,由它制备人造橡胶——顺式聚异戊二烯的一种合成路线如下:

已知:在一定条件下可发生下列反应:
① E
E
②
(1)乙醛的核磁共振氢谱中有______种峰,峰面积之比为_______。
(2)题给信息中反应②的反应类型是_____________。
(3)C中含氧官能团的名称是_______,D的系统命名法的名称是______。
(4)D分子中最多______个原子共面。
(5)下列物质能与E发生化学反应的是_______(填编号)。
a.溴水 b.酸性高锰酸钾 c.乙酸
(6)写出A→B的化学方程式_______。
(7)写出D生成顺式聚异戊二烯的化学方程式______________。
(8)写出与A物质具有相同官能团的异戊二烯的三种同分异构体结构简式_______、______、______。
查看答案和解析>>
科目: 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu.Fe三种金属元素组成,回答下列问题:
(1)①铜元素位于周期表中_____区。Cu2+离子的价层轨道表示式为____。
②锰、铁、钴三种元素的逐级电离能如下表:
电离能/KJ/mol | I1 | I2 | I 3 | I4 |
Mn | 717.3 | 1509.0 | 3248 | 4940 |
Fe | 762.5 | 1561.9 | 2957 | 5290 |
Co | 760.4 | 1648 | 3232 | 4950 |
铁元素的第三电离能明显低于锰元素和钴元素,其原因是____。
③实验室可用赤血盐K3[Fe(CN)6]检验Fe2+离子,在赤血盐中铁元素的化合价为____,中心离子的配位数为______。
(2)利用反应:X+C2H2+NH3→Cu2C2+NH4Cl(未配平)可检验乙炔。
①化合物X晶胞结构如图,据此可知X的化学式为_______。

②乙炔分子中σ键与π键数目之比为______,碳原子的杂化方式为_______;NH4+空间构型为______(用文字描述)。
(3)①下列三种化合物a.AlCl3 b.NaCl c.Al2O3沸点由高到低依次是_______(填编号),其原因是____________。
②Al单质中原子采取面心立方最密堆积,其晶胞边长为0.405nm,列式表示Al单质的密度_______g/cm3(不必计算出结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题。用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

作负极的物质是___________;正极的电极反应式是_____________。
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如下:

在pH =4.5的水体中,NO3-的去除率低的原因是_____________。
(3)为提高pH =4.5的水体中NO3-的去除率,某课题组在初始pH =4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图:

此实验可得出的结论是____,Fe2+的作用可能是_________。(2)中NO3-去除率和铁的最终物质形态不同的原因______________。
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有_______。(写出一条)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com