
科目: 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是( )
A. NO2溶于水:3NO2+H2O=2H++2NO3-+NO
B. 漂白粉溶液呈碱性的原因:ClO-+H2O![]() HClO+OH-
HClO+OH-
C. 酸性条件下用H2O2将海带灰中I-氧化:H2O2+2I-+2H+=I2+2H2O
D. 氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只能有共价键
C. 由X、Y两种元素形成的化合物都是酸性氧化物
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目: 来源: 题型:
【题目】以黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)为原料制备颜料铁红(Fe2O3)、晶体E,回收H和重金属混合物的生产工艺流程如下图所示:

请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为__________________。
Fe在周期表中的位置为第________周期第Ⅷ族。
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是________________________。过程①溶解烧渣所需试剂中溶质的化学式为__________________。
反应②的化学方程式:______________________________________________________。
(3)反应③的目的是____________________________________。
气体Z的电子式:__________________。
写出反应④的离子方程式:______________________________________________________。
(4)将回收的G溶于少量水,所得溶液中所有离子的浓度由大到小依次是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列A~H八种物质存在如下图所示的转化关系(反应条件、部分产物未标出)。已知A是正盐,B能使品红溶液褪色,G是红棕色气体。试回答下列问题:
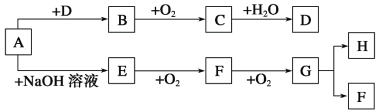
(1)写出下列各物质的化学式:A________________;B________________。
(2)按要求写出下列反应的有关方程式
E→F反应的化学方程式_____________________________________________________;
G→H反应的离子方程式_____________________________________________________。
(3)写出H的浓溶液与木炭反应的化学方程式_______________________________________。
(4)检验D中阴离子的方法是___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据实验室制备氯气的装置(如下),回答下列问题;

(1)仪器A 和 B名称___________ ;____________
(2)写出B中发生反应的离子方程式_____________________________________
(3)装置C的作用__________________________________________
(4)装置D的作用________________________________________________
(5)检验E中氯气已经收集满的方法_________________________________________
(6)写出F中发生的反应方程式______________________________________________
(7)每生成0.5mol氯气转移________________个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】NO2是大气污染物,但只要合理利用也是重要的资源。回答下列问题:
(1)NO2可以被NaOH溶液捕获生成两种钠盐,溶液呈碱性,写出反应的化学方程式______________,已知常温下,HNO2的电离平衡常数为Ka=5.0×10-4,则0.1mo/L NaNO2中c(OH-)=_____________(已知![]() )
)
(2)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步,反应情况如下表:
2NO2(g)的反应历程分两步,反应情况如下表:
反应 | 速率表达式 | 反应热 |
反应I:2NO(g) |
| △H1<0 |
反应II:N2O2(g)+O2(g) |
| △H2<0 |
反应2NO(g)+O2(g) ![]() 2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H______(用△H1、△H2表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用
2NO2(g)达到平衡状态,若升高温度,K将____(填“增大”、“减小”或“不变”),平衡常数的表达式K=____(用![]() 、
、![]() 、
、![]() 、
、![]() 表示)
表示)
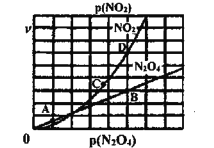
(3)反应N2O4(g) ![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强关系为:υ(N2O4)=k1· p(N2O4),υ(NO2)=k2· p(NO2),其中![]() 、
、![]() 是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态对应的两个点是___________
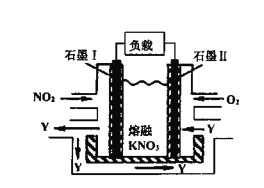
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。Y的化学式为____________
查看答案和解析>>
科目: 来源: 题型:
【题目】新型抗溃疡药瑞巴匹特,可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
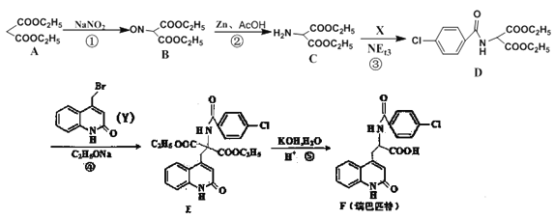
(1)A的化学名称为______________,C的核磁共振氢谱具有_________________组峰
(2)A与足量的NaOH溶液反应的化学方程式为______________
(3)化合物F中含氧官能团的名称为__________________,化合物F的分子式为_____________
(4)反应①~③中,属于取代反应的是__________________(填序号)
(5)C→D的转化中,生成的另一种产物为HCl,则C→D反应的化学方程式为__________
(6)已知Y中的溴原子被--OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:___________________
I.分子中含有一个苯环和一个五元环,且都是碳原子环
II.苯环上有两个取代基,且处于对位
III.能与NaHCO3溶液发生反应
(7)已知CH3CH2OH![]() CH3CH2Br,以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图如下:HOCH2CH2CH2OH
的合成路线流程图如下:HOCH2CH2CH2OH![]() 物质X
物质X![]() 物质Y
物质Y![]()
![]() ,则物质X为__________,物质Y为____________
,则物质X为__________,物质Y为____________
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),下列有关Ts的说法不正确的是( )
”,tián),下列有关Ts的说法不正确的是( )
A. Ts的电子所在最高能层符号是Q B. Ts的原子有一个未配对电子
C. Ts的电负性在同周期主族元素中最大 D. Ts原子有7种能量相同的电子
查看答案和解析>>
科目: 来源: 题型:
【题目】某氮肥厂氨氮废水中的氮元素多以NH![]() 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
用离子方程式表示加NaOH溶液的作用:______________________________________。
(2)过程Ⅱ:在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

第一步反应是________反应(选填“放热”或“吸热”),判断依据是________。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;2PCl3+O2=2POCl3。某化学学习小组用装置甲合成PCl3,并用装置乙采取PCl3氧化法制备POCl3

(1)氯元素在周期表中的位置是_____________
(2)H3PO3中所含元素原子半径由小到大的顺序为_____________
(3)能比较出氯的非金属性比磷的非金属性强的是______________
A.HCl酸性比H3PO4的强 B.HCl稳定性比PH3的强
C.HClO4的酸性比H3PO3的强 D.PCl3中P显正三价,C1显负一价
(4)图甲碱石灰的作用除了处理尾气外还有防止_____________进入烧瓶,影响产品纯度的作用
(5)图乙A装置中化学反应方程式是_____________
(6)POCl3水解的化学反应方程式为______________
(7)C中反应温度控制在60~65℃,其原因是____________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com