
科目: 来源: 题型:
【题目】现代工业常以氯化钠、二氧化碳和氨气为原料制备纯碱,部分工艺流程如下:
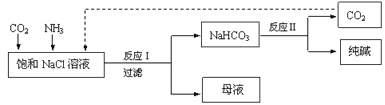
有关说法错误的是
A.反应Ⅰ原理为CO2 + NH3+ NaCl + H2O → NaHCO3↓ + NH4Cl
B.向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3
C.反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱
D.往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向10mL0.1mol·Lˉ1NaOH溶液中加入0.1mol·Lˉ1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(Aˉ)>c(H+)>c(HA)
B.pH=7时,加入HA的体积<10mL
C.pH=7时,c(Na+)=c(Aˉ)+c(HA)
D.b点所示溶液中c(Aˉ)>c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在水溶液中1 mol ![]() 的能量(kJ)相对大小如下图所示。下列有关说法错误的是
的能量(kJ)相对大小如下图所示。下列有关说法错误的是

A. 上述离子中结合![]() 能力最强的是E
能力最强的是E
B. 上述离子中最稳定的是A
C. 上述离子与![]() 结合有漂白性的是B
结合有漂白性的是B
D. ![]() 反应物的键能之和小于生成物的键能之和
反应物的键能之和小于生成物的键能之和
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在 2L的密闭容器中,加入1molX(g)和 2molY(g)发生反应:X(g)+mY(g)3Z(g) ΔH=-Q kJ·molˉ1(Q>0),10min后该反应达到平衡时,X、Y的物质的量分别为0.9mol、1.8mol。下列叙述不正确的是
A.m=2
B.在0~10min内,X的反应速率为 0.005mol·Lˉ1·minˉ1
C.10min后,X的消耗速率等于Y的生成速率
D.在0~10min内,X和 Y反应放出的热量为 0.1Q kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.9 g D2O中含有的电子数为5NA
B.46 g NO2和N2O4混合气体中含有原子数为3NA
C.1 mol C2H6分子中含共价键总数为6NA
D.7.1 g C12与足量NaOH溶液反应,转移的电子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B. 原溶液一定存在Cl﹣,可能存在Na+
C. 原溶液中c(Cl﹣)≥0.1molL﹣1
D. 若原溶液中不存在Na+,则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A.锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑
B.铜和氯化铁溶液反应:Fe3++Cu=Fe2++Cu2+
C.实验室制备氯气的反应:MnO2+2Clˉ+4H+![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.硫酸氢铵溶液和少量氢氧化钠溶液反应:OHˉ+NH4+=NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为短周期的一部分,Y原子最外层电子数是其电子层数的 2倍,下列说法正确的是

A.Y的氢化物比 Z的氢化物稳定
B.原子半径大小为Z>Y>R>X
C.Y、R形成的化合物 YR2能使酸性 KMnO4溶液褪色
D.四种元素中最高价氧化物的水化物酸性最强的是 Y
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb+PbO2 +2H2SO4=2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________(写化学式);
②工作时正极反应为__________________________________________;
③工作时,电解质溶液中阴离子移向________极(填“正”或“负”)。
(2)如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:

①电源A上的a为________极(填“正”或“负”);
②滤纸B上发生的总化学方程式为___________________;
③欲在电槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极f上发生的反应为________________________。电槽中放的镀液可以是___________(只需写出一种即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)写出碳酸第一步电离的离子方程式:_____________________________
(2)写出氯化铵溶液水解的离子方程式: ____________________________
(3)实验室中有一未知浓度的稀盐酸,某同学在实验室测定盐酸的浓度。请完成下列填空:
首先,配制100mL 0.10mol/L NaOH标准溶液。
① 配制过程中,请计算需要称量_____g氢氧化钠固体。然后,取20.00mL待测盐酸放入锥形瓶中,并滴加2-3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2-3次,记录数据如下。
编号 | NaOH溶液的浓度mol/L | 滴定消耗NaOH溶液的体积mL | 待测盐酸的体积mL |
1 | 0.10 | 22.02 | 20.00 |
2 | 0.10 | 21.98 | 20.00 |
3 | 0.10 | 23.98 | 20.00 |
② 下列滴定操作的顺序正确的是 (_____)
a.检查滴定管是否漏水
b.用蒸馏水洗涤玻璃仪器
c.用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
d.装标准溶液和待测液并排出气泡调整液面(记录初始读数)
e.取一定体积的待测液于锥形瓶中并滴加适量指示剂
f.滴定
A. acbdef B. abcdef C. bcadef D. deabcf
③ 滴定达到终点的标志是________________________。
④ 根据上述数据,可计算出该盐酸的浓度为________。
⑤ 造成测定结果偏高的原因可能是 (_____)
A. 振荡锥形瓶时,部分未知液溅出液体
B. 滴定终点读数时,俯视滴定管的刻度,其他操作正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D. 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com