
科目: 来源: 题型:
【题目】金属钛(Ti)性能优越,钛被称为“第三金属”(铁、铝分为第一、二金属),工业以TiO2冶炼Ti的主要反应有:①TiO2+2C+2Cl2![]() TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg![]() 2MgCl2+Ti下列叙述正确的是( )
2MgCl2+Ti下列叙述正确的是( )
A. 反应①是置换反应 B. 反应②是复分解反应
C. 反应①中TiO2是氧化剂 D. 反应②中金属镁是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是
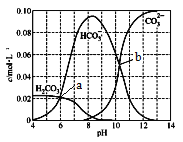
A. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. 随pH增大,![]() 数值先减小后增大
数值先减小后增大
C. 25℃时,碳酸的第一步电离常数Ka1=10-6
D. 溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-)
查看答案和解析>>
科目: 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】加热10g碳酸钠和碳酸氢钠的混合物质至质量不再变化,剩余固体质量8.45g,剩余物质是__________,反应方程式为___________原混合物中碳酸钠质量分数为_______
查看答案和解析>>
科目: 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如下(部分反应条件略去):

已知:
①有机物A的质谱与核磁共振氢谱图如下:

②
③
回答下列问题:
(1)A的名称是__________________;C中含氧官能团的名称是________________。
(2)反应②的反应类型是____________________。
(3)反应①的化学方程式是__________________________。
(4) F的结构筒式是_____________________。
(5)同时满足下列条件的G的同分异构体共有___________种(不含立体结构);写出其中一种的结构简
式:________________。
①能发生银镜反应 ②能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1 mol该物质最多能与8 mol NaOH反应
(6) 参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备 的合成路线:_______________________。
的合成路线:_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列混合物分别可以用什么方法分离
酒精与水_____________,NaCl与泥沙________,KNO3与NaCl_____ ,溴水提取溴________ 。
(2)甲烷的电子式________,乙烯的结构式 ________________,乙炔空间构型_____________,苯分子中_________(有或无)碳碳双键,所以苯________ (能或不能)使高锰酸钾褪色
(3)可以用______(化学式)溶液检验苯酚的存在,现象是溶液呈__________乙醛与新制的氢氧化铜共热现象是___________生成。
(4)在乙醇的化学性质中,各反应的断键方式可概括如下:(填序号)
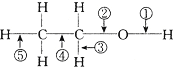
消去反应:______ ;与金属反应:_______;催化氧化:___________; 与HX反应:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取乙烯并检验乙烯性质的装置如下图。
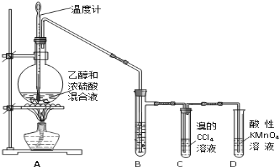
请回答有关问题:
(1)烧瓶中除反应物以外,还应放2-3块碎瓷片,目的是_________________;
(2)烧瓶中产生乙烯的反应方程式为:_________________,反应类型为:_________________;C中发生反应的化学方程式为:_________________,反应类型为:_________________;
(3)反应一段时间后,可观察到D中的现象是:_________________;
(4)B中所装的溶液是:_________________溶液,起的作用是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如下图所示。
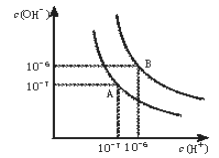
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)在100℃下,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为______________。
(3)在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积约为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为_____________mol·L-1.
(2)达到滴定终点的标志是_______________________________________________________
(3)以下操作造成测定结果偏高的原因可能是__________________。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 未用标准液润洗碱式滴定管
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2熔点为-59.5℃,沸点为11.0℃,温度过高可能引起爆炸,易溶于水,易与碱液反应。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某同学设计了如图装置来制取、收集ClO2并测定其质量。

实验I:制取并收集ClO2,装置如图所示。
(1)装置A除酒精灯外,还必须添加__________装置,目的是____________。装置B应该添加_____________(填“冰水浴”、“沸水浴”或“60℃的热水浴”)装置。
(2)装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式_____________。
实验II:测定ClO2的质量,装置如图所示。过程如下:

①在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加![]() 硫酸溶液;
硫酸溶液;
②按照如图组装好仪器:在玻璃液封管中加入水,浸没导管口;
③将生成的ClO2气体由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封液倒入锥形瓶中,再向锥形瓶中加入几滴淀粉溶液;
④用cmol/L Na2S2O3标准液滴定锥形瓶中的液体,共用去VmL Na2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)。
(3)装置中玻璃液封管的作用是______________。
(4)滴定终点的现象是___________________。
(5)测得通入ClO2的质量m (ClO2)=_______![]() (用整理过的含
(用整理过的含![]() 的代数式表示)。
的代数式表示)。
(6)判断下列操作对m (ClO2)测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制Na2S2O3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com