
科目: 来源: 题型:
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是__________;
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是__________;
(3)元素⑦的氢化物分子式为__________,该氢化物常温下和元素①的单质反应的离子方程式是__________,该氢化物与元素⑧的单质反应的离子方程式是__________;
(4)①和⑧的最高价氧化物对应的水化物化学式为__________和__________。①和⑨两元素形成化合物的化学式为__________,该化合物灼烧时焰色为__________,该化合物的溶液与元素⑧的单质反应的离子方程式为__________;
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在焊接铜器时可用NH4Cl溶液除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl → Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是
A. 反应中被氧化和被还原的元素分别为Cu和N
B. 反应中氧化剂和还原剂的物质的量之比为3∶2
C. 反应中产生0.2 mol气体时,转移0.6 mol电子
D. 该反应中被还原的CuO占参与反应CuO的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是__________;(用元素符号回答,下同)
(2)化学性质最不活泼的单质是__________;
(3)④、⑤、⑥、⑦中形成的简单离子半径由大到小的顺序为是__________;
(4)某原子结构示意图为![]() ,其对应的元素符号是__________;
,其对应的元素符号是__________;
(5)H2S和HCl中,热稳定性较强的是__________;
(6)NaOH、Mg(OH)2、Al(OH)3中,碱性最强的是__________;属于两性氢氧化物的是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列物质:①He;②![]() ;③
;③![]() ;④CaO;⑤
;④CaO;⑤![]() ;⑥
;⑥![]() ;⑦
;⑦![]() ;⑧
;⑧![]() ;⑨KOH; 请用序号填空:
;⑨KOH; 请用序号填空:
(1)只含离子键的物质是______________;
(2)既含离子键又含共价键的物质是____;
(3)只含极性键的物质是______________;
(4)属于共价化合物的是______________;
(5)既含离子键又含非极性键的物质是______ ;
(6)不存在化学键的物质是__________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成。请回答下列问题:

(l)铝热反应原理____________(写化学方程式);试剂A为_____(写化学式)。实验现象:_________、有褐色固体生成。
(2)将褐色硬块处理成粉未状,研究小组首先排除了含有单质Al杂质的可能性。
实验方法:首先取少量粉未加入_____溶液中;
实验现象:__________;实验结论是:粉末中含有Al2O3而没有Al。
(3)根据上述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。提出假设:
假设l:固体粉末中除Al2O3外还有Fe;
假设II:固体粉末中除Al2O3外还有Fe和Fe2O3。
设计方案并实验:
实验步骤 | 实验现象 | 实验结论 |
①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设II不成立 |
②再滴入几滴0.01mol/L KSCN 溶液 | 溶液不变色 |
你认为上述结论是否合理,_________,理由是_______________。
(4)取上述实验所得溶液,滴入适量氯水溶液变红色。此时涉及的离子反应方程式为:_________________、____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】①甲烷、②乙烷、③乙烯、④苯、⑤甲苯、⑥二甲苯、⑦乙醇、⑧乙酸,它们都是常见的重要化工原料。
(1)上述物质中,氢元素的质量分数最大的是______填分子式;
(2)分别写出⑦、⑧中所含官能团的名称____________、____________二者发生酯化反应的化学方程式为_________________________________________________,如果用4.6g乙醇和9.0g乙酸充分反应制得乙酸乙酯5.28g,则本实验的产率是:__________产率指的是目标生成物的实际产量与理论产量的比值。
(3)上述物质中,能发生加成反应的烃类物质有:__________________________填序号。
(4)下列物质中,不能通过乙烯加成反应得到的是______填序号。
a.CH3CH3b.CH3CHCl2c.CH3CH2Br
(5)苯、甲苯、二甲苯是用途广泛的有机溶剂。二甲苯的结构有______种,其中一种被称为“PX”,它的一氯代物只有两种,则“PX”的结构简式是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在通电条件下,用如图所示装置由乙二醛(OHC-CHO)制备乙二酸(H00C-COOH)。其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl。下列说法正确的是( )

A. 盐酸是起提供Cl-和增强导电性的作用
B. Pt1的电极反应为:4OH--4e-=2H2O+O2↑
C. 每消耗0.1mol乙二醛在Pt1极放出2.24L气体(标准状况)
D. 每得到lmol乙二酸将有2molH+从右室迁移到左室
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知拆开1mo1H-H键、1molN≡N键、lmolN-H键分别需要吸收的能量为436kJ、946kJ、391kJ。则生成1mo1 NH3时反应放出___________kJ 的热量。
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是________(填序号)。

(3)直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。

①三种乙醇燃料电池中正极反应物均为______________________;
②碱性乙醇燃料电池中,电极a上发生的电极反应式为_______________________________;
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,电极b上发生的电极反应式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是
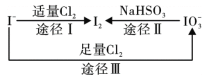
A. 氧化性的强弱顺序为:Cl2 >IO3- >I2
B. 一定条件下, I-与IO3-反应可能生成I2
C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com