
科目: 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是 ( )
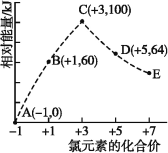
A.这些离子中结合H+能力最强的是A
B.A、B、C、D、E五种微粒中C最稳定
C.C→B+D的反应,反应物的总键能小于生成物的总键能
D.B→A+D反应的热化学方程式为3ClO-(aq)=ClO3- (aq)+2Cl-(aq) ΔH=+116 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】钠-CO2电池的工作原理如图所示,吸收的CO2转化为Na2CO3固体和碳,沉积在多壁碳纳米管(MWCNT)电极表面,下列说法不正确的是( )
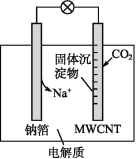
A.负极反应式为Na-e-=Na+
B.多壁碳纳米管(MWCNT)作电池的正极
C.可以用乙醇代替四甘醇二甲醚作有机溶剂
D.电池总反应式为4Na+3CO2=2Na2CO3+C
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A.1molCH4中含有的电子数为8NA
B.2L0.3mol·L-1的硫酸钾溶液中钾离子的物质的量为0.6NA
C.常温常压下,32gO2和O3的混合气体所含原子数为2NA
D.标准状况下,22.4LH2O所含的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氧化钠和过氧化钠的叙述中不正确的是
A.Na2O2是淡黄色固体,Na2O是白色固体,阴阳离子个数比均为1:2
B.Na2O2和Na2O均为碱性氧化物,都能与水反应生成NaOH
C.Na2O和Na2O2均能与CO2发生反应,都有Na2CO3生成
D.2gH2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol H2O的质量为18 g/mol
B. 3.01×1023个SO2分子的质量为32 g
C. 4 g NaOH溶于1L水中,所得溶液的物质的量浓度为0.1 mol/L
D. 标准状况下,1 mol任何物质体积均为22.4 L
查看答案和解析>>
科目: 来源: 题型:
【题目】温度恒定的条件下,在2 L容积不变的密闭容器中,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
A.v(SO2)∶v(O2)=2∶1B.10 s内,v(SO3)=0.05 mol·L-1·s-1
C.SO2的平衡转化率为25%D.平衡时容器内的压强是反应前的5/6倍
查看答案和解析>>
科目: 来源: 题型:
【题目】右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
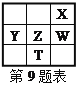
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z是中学化学常见的三种物质,它们之间的相互转化关系如下![]() 、Y、Z、E、F为英文字母,部分反应条件及产物略去
、Y、Z、E、F为英文字母,部分反应条件及产物略去![]()

I.若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体。
(1)则Y和新制氯水主要成分反应生成两种强酸的化学方程式______________。
(2) Y气体的大量排放会形成酸雨,在工业上可以用足量氨水吸收,化学方程式为________________。
(3)Z的水溶液可以制得某种强酸E。实验室用![]() 的浓
的浓![]() 溶液配制
溶液配制![]() 稀E溶液
稀E溶液![]() 。
。
①制该稀E溶液需要使用的玻璃仪器有胶头滴管、量筒、烧杯、____和_____;
②算所需E浓溶液的体积为___mL(保留1位小数)。
II.若Z是淡黄色固体粉末。在呼吸面具或潜水艇中由Z和CO2制备氧气的化学反应方程式为____。
III.若Z是红棕色气体。
(1)试写出Z与水反应制备另一种强酸F的化学方程式_______。
(2)2.0g铜镁合金完全溶解于![]() 密度为
密度为![]() 质量分数为
质量分数为![]() 的浓F溶液中,得到Z和
的浓F溶液中,得到Z和![]() 和
和![]() 均为浓F溶液的还原产物
均为浓F溶液的还原产物![]() 的混合气体
的混合气体![]() 标准状况
标准状况![]() ,向反应后的溶液中加入
,向反应后的溶液中加入![]() 溶液,当金属离子全部沉淀,得到
溶液,当金属离子全部沉淀,得到![]() 沉淀。则合金中铜与镁的物质的量之比为_____,加入NaOH溶液的体积为_____mL。
沉淀。则合金中铜与镁的物质的量之比为_____,加入NaOH溶液的体积为_____mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是 ( )
A.乙醛和丙烯醛(![]() )不是同系物,分别与氢气充分反应后的产物也不是同系物
)不是同系物,分别与氢气充分反应后的产物也不是同系物
B.O2与O3互为同素异形体,1H、2H、3H是氢元素的不同核素
C.C2H6O有两种同分异构体;2-甲基戊烷的结构简式为CH3CH2CH2CH(CH3)2
D.氨基酸分子中均含有羧基(—COOH)和氨基(—NH2)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:


(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为________________。
(2)由图分析选择冷却结晶的原因是_______________。
(3)向Na2Cr2O7母液中加碱液调pH的目的是_____________。
(4)分离得到固体A的方式为______,用热水洗涤固体A,回收的洗涤液转移到母液____(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。
(5)生产工艺中含Cr2O72-的废水常用于处理废水中的CN-,处理过程按下图流程进行:

步骤③中,每处理0.3 mol Cr2O72-时转移电子1.8 mol,该反应的离子方程式为________;
②处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于Feπ[FexIIICr(2-x)III]O4 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列结论正确的是_______。
A.x=0.5,a=6 B.x=0.5,a=10
C.x=1.5,a=6 D.x=1.5,a=10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com