
科目: 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小
B. 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
C. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D. 保持温度不变,活塞P可自由移动,达到新的平衡后,乙中C的浓度和甲中C的浓度相等
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年12月1日国际纯粹与应用化学联合会宣布,将合成的四种新元素命名为113号 (缩写为Nh)、115号(Mc)、117号(Ts)和118号(Og)。下列说法正确的是
A. 113号元素的氧化物为两性氧化物
B. 115号元素位于第六周期第VA族
C. 117号元素的某种原子,核内含176个中子,此原子是![]() Ts
Ts
D. 118号元素的原子最外层有8个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】学习化学应该明白“从生活中来,到生活中去”道理,并加以实践。氯气是一种化学性质活泼的非金属单质,工业上可用氯气制取漂白粉、有机溶剂等。
(1)实验室中所用少量氯气常用下列方法制取:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O。请将该反应改写成离子方程式:________________________________________。
Cl2↑+MnCl2+2H2O。请将该反应改写成离子方程式:________________________________________。
(2)甲同学设计如图所示装置研究氯气能否与水发生反应。气体X是含有少量空气和水蒸气的氯气。请回答下列问题:

①浓硫酸的作用是___________________________________________。
②证明氯气和水反应的实验现象为____________________________________________。
③此实验装置还不够完善,应该在D处添加的实验装置是_________________________,D处反应的化学方程式为__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
【资料查阅】

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。

请回答下列问题:
(1)D装置的作用_________________。
(2)装置D中发生的氧化还原反应的离子方程式是________________。
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是____________。
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuO杂质,根据资料信息分析:则产生的原因是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式__________________________________________,当该反应以表中数据反应完全时转移电子数为_______________NA
(2)V1 ______
(3)根据上表中的实验①、②数据,可以得到的结论是_____。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)
(5)该小组同学根据经验绘制了 n (Mn 2+ )随时间变化的趋势如图 1 所示,但有同学查阅已有的实验资料发现,该实验过程中 n (Mn 2+ ) 随时间变化的实际趋势如图 2 所示。

该小组同学根据图 2 所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①该小组同学提出的假设是_____。
②若该小组同学提出的假设成立,应观察到_________________________________现象。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,取50ml 0.50 mol/L 盐酸、50ml 0.55 mol/L NaOH溶液进行反应, 请回答下列问题:

(1)该装置还缺少的玻璃仪器为 _________________ ,若做1次完整的中和热测定实验,则温度计需使用_______ 次,
(2)倒入NaOH溶液的正确操作是______________。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)下列操作使测得中和热偏大的是_________
A.测量酸的温度后没有清洗温度计在测量碱 B.在量取盐酸时仰视读数
C. 使用铜棒搅拌反应液 D.将盐酸的体积量取为52.0ml
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32-、Cl-、Mg2+中的一种或几种离子。
①向此溶液中滴加足量稀盐酸无明显现象。
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生。
(1)原溶液中一定含有的离子是________,一定不含有的离子是________,不能确定是否含有的离子是________。
(2)②中反应的离子方程式为___________________。
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
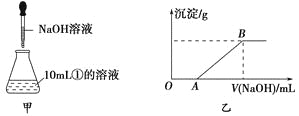
①OA段反应的离子方程式为_____________________。
②AB段反应的离子方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以苯酚为原料合成防腐剂尼泊金丁酯(对羟基苯甲酸丁酯)、香料G (结构简式为![]() )的路线如下:
)的路线如下:

已知:
①
② ![]()
注:R、R′为烃基或H原子,R″为烃基
请回答:
(1)下列说法正确的是_________。
A.反应②F→G,既属于加成反应,又属于还原反应
B.若A→B属于加成反应,则物质X为CO
C.甲物质常温下是一种气体,难溶于水
D.上述合成路线中,只有3种物质能与FeCl3溶液发生显色反应
(2)上述方法制取的尼泊金酯中混有属于高聚物的杂质,生成该物质的化学方程式为_________。
(3)E的结构简式为_____________。
(4)写出同时符合下列条件并与化合物B互为同分异构体的有机物的结构简式____________。
①分子中含有苯环,无其它环状结构;
②1H-NMR谱表明分子中有4种氢原子:
③能与NaOH溶液反应。
(5)设计以乙烯为原料制备1-丁醇的合成路线(用流程图表示,无机试剂任选)____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知钠与氧气在不同条件下会发生不同的反应。
(1)将金属钠长时间放置于空气中可发生如下一系列变化,写出此变化中①③步转化的化学方程式:
Na![]() Na2O
Na2O![]() NaOH
NaOH![]() Na2CO3·10H2O→Na2CO3
Na2CO3·10H2O→Na2CO3
①___________;
③__________。
(2)将钠置于坩埚内,在空气中加热,可燃烧生成一种淡黄色物质。
①钠在空气中燃烧的化学方程式为___________。
②某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
Na2O2与水反应的离子方程式是___________,甲同学认为过氧化钠中阴离子结合水中氢离子生成了H2O2,溶液a中的H2O2将酚酞氧化导致褪色。用实验证实H2O2的存在:取少量溶液a,加入试剂___________(填化学式),有气体产生。
查看答案和解析>>
科目: 来源: 题型:
【题目】①5.2g的气态乙炔(C2H2)在氧气中燃烧,生成二氧化碳和液态水,放出260kJ的热量,其热化学方程式为:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,则11.2L(标准状况)乙炔完全燃烧生成气态水时放出的热量是_________kJ。
②已知:CH4 的燃烧热为890 kJ/mol,H2的热值为142.5kJg-1,现有标准状况下22.4 L CH4和H2的混合气体完全燃烧时,放出的热量为527kJ,求混合气体中CH4 和H2的体积比_____________
③将1mol NO2投入到1L容器中进行 2NO2(g)![]() N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com