
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. Cu2S(s)![]() Cu(s)
Cu(s)![]() CuCl2(s)
CuCl2(s)
B. SiO2(s)![]() H2SiO3(s)
H2SiO3(s)![]() Na2SiO3(aq)
Na2SiO3(aq)
C. Fe(s)![]() Fe2O3(s)
Fe2O3(s)![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)
D. NaCl(aq)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(aq)
NaOH(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,单位都为mol/(Ls),则正确的关系是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Ca(CH3COO)2溶液与硫酸反应:Ca2++SO42-=CaSO4↓
B. Cl2与热的NaOH溶液反应:Cl2+6OH-![]() Cl-+ClO3-+3H2O
Cl-+ClO3-+3H2O
C. 电解K2MnO4碱性溶液制KMnO4:2MnO42-+2H+![]() 2MnO4-+H2↑
2MnO4-+H2↑
D. NaHCO3与过量Ba(OH)2溶液反应:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O![]() 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
A. 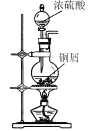 制备SO2
制备SO2
B. 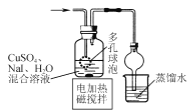 制备CuI并制备少量含SO2的溶液
制备CuI并制备少量含SO2的溶液
C. 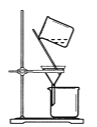 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
D. 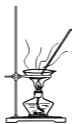 加热干燥湿的CuI固体
加热干燥湿的CuI固体
查看答案和解析>>
科目: 来源: 题型:
【题目】Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 晶体,俗名叫 ;
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是 ,它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是 ;
(4)Q分别与Y、Z形成的共价化合物的化学式是 和 ,Q与Y形成的分子的电子式是 ,属于 分子(填“极性”或“非极性”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取Cu2(OH)2SO4的工艺流程如下:
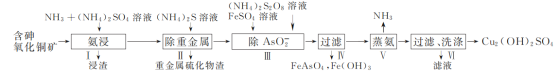
(1) 步骤Ⅰ“氨浸”时,控制温度为50~55 ℃,pH约为9.5,含铜化合物转化为[Cu(NH3)4]SO4溶液。
① CuO被浸取的离子方程式为________。
②浸取温度不宜超过55 ℃,其原因是________。
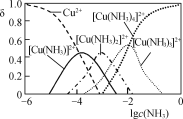
③ Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(δ)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1 L浸取液(由等物质的量NH3和NH4+组成)将amolCu2(OH)2CO3全部浸出为[Cu(NH3)4]2+(CO32-转变为HCO3-,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是________。
(2) “除AsO2-”时,FeSO4需过量,一方面使AsO2-沉淀完全,另一目的是________。
(3) “蒸氨”时发生反应的化学方程式为________。
(4) 为了实现生产过程中物质循环利用,可采取的措施为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】RLClaisen双酯缩合反应的机理如下:2RCH2COOC2H5![]()
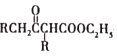 +C2H5OH,利用该反应制备化合物K的一种合成路线如图
+C2H5OH,利用该反应制备化合物K的一种合成路线如图
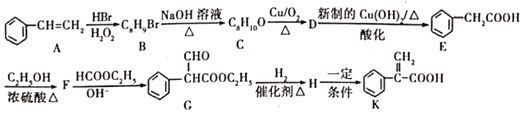
试回答下列问题:
(1)A与氢气加成所得芳香烃的名称为______;A→B的反应类型是______;D中含氧官能团的名称是______。
(2)C的结构简式为______;F→G的反应除生成G外,另生成的物质为______。
(3)H→K反应的化学方程式为______。
(4)含有苯环结构的B的同分异构体有______种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为______(任写一种即可)。
(5)乙酰乙酸乙酯(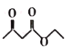 )是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
)是一种重要的有机合成原料,写出由乙醇制备乙洗乙酸乙時的合成路线(无机试剂任选):______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是__,画出配合物离子[Cu(NH3)4]2+中的配位键__.
(2)根据VSEPR模型,H3O+的分子立体结构为__,BCl3的立体结构为__.
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种)
正四面体分子__,三角锥形分子__,V形分子______。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属磷化物(如璘化锌)是常用的蒸杀虫剂。我国卫生部门规定:粮食中化物(以PH3计)的含量不超过0.050mg:kg-1时,粮食质量方达标。现设计测定粮食中残留磷化物含量的实验如下
(资料查阅)磷化锌易水解产生PH3;PH3沸点为-88℃,有剧毒性、强还原性、易自然。
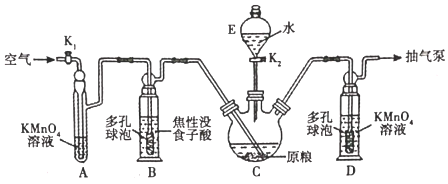
(用量标准]如图:装置A、B、E中盛有的试剂均足量;C中装有100原粮;D中盛有40.00mL6.0×10-5molL-1KMnO4溶液(H2SO4酸化)。
(操作流程)安装仪器并检査气密性→PH、的产生与吸收一转移KMnO4吸收溶液→用Na2SO3标准溶液滴定。
试回答下列问题:
(1)仪器E的名称是______;仪器B、D中进气管下端设计成多孔球泡形状,目的是______。
(2)A装置的作用是______;B装置的作用是吸收空气中的O2,防止______。
(3)下列操作中,不利于精确測定出实验结果的是______(选填序号)。
a.实验前,将C中原粮预先磨碎成粉末
b.将蒸馏水预先煮沸、迅速冷却并注入E中
c.实验过程中,用抽气泵尽可能加快抽气速率
(4)弹化锌发生水解反应时除产生PH3外,还生成______(填化学式)。
(5)D中PH3被氧化成H3PO4,该反应的离子方程式为______。
(6)把D中吸收液转移至容量瓶中,加水稀释至250.00mL,取25.00mL于锥形瓶中,用5.0×10-5molL-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液10.00mL.则该原粮中磷化物(以PH3计)的含量为______mgkg-1,该原粮质量______(填“达标”或“不达标“)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com