
科目: 来源: 题型:
【题目】下列说法中正确的是
A.由Na2CO3 + SiO2 ![]() Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S存在于多种燃气中,脱除燃气中H2S的方法很多。
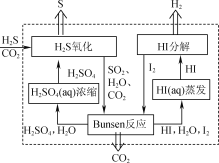
(1) 2019年3月《science direct》介绍的化学链技术脱除H2S的原理如图所示。
①“H2S氧化”反应中氧化剂与还原剂的物质的量之比为________。
②“HI分解”时,每1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,写出该反应的热化学方程式:________。
③“Bunsen反应”的离子方程式为________。
(2) 电化学干法氧化法脱除H2S的原理如图所示。阳极发生的电极反应为________;阴极上COS发生的电极反应为________。
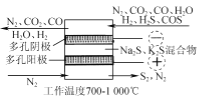
(3) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
(Ⅰ) H2S(g)![]() H2S(aq)
H2S(aq)
(Ⅱ) H2S(aq) ![]() H++HS-
H++HS-
(Ⅲ) HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。

①吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是________。
②图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,这是由于________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NVCO{化学式可表示为(NH4)a[(VO)b(CO3)c(OH)d]·10H2O}能用于制取VO2,实验室可由V2O5、N2H4·2HCl、NH4HCO3为原料制备NVCO。
(1)原料NH4HCO3中HCO3-水解的离子方程式为____________。
(2) N2H4·2HCl是N2H4的盐酸盐。已知N2H4在水中的电离方式与NH3相似,25 ℃时,K1=9.55×10-7。该温度下,反应N2H4+H+![]() N2H5+的平衡常数K=________(填数值)。
N2H5+的平衡常数K=________(填数值)。
(3)为确定NVCO的组成,进行如下实验:
①称取2.130 g样品与足量NaOH充分反应,生成NH3 0.224 L(已换算成标准状况下)。
②另取一定量样品在氮气氛中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示(分解过程中各元素的化合价不变)。
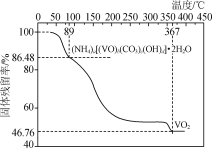
根据以上实验数据计算确定NVCO的化学式(写出计算过程)________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。0.05mol某烃完全燃烧后,测得生成的二氧化碳为5.6L(STP)、生成的水为5.4g。请通过计推导该烃的分子式,并写出它可能的结构简式及对应的名称。_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填 “晶体”或“非晶体”),可通过__________方法鉴别。
(2)基态Ni2+的核外电子排布式为__________;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO__________FeO(填“<”或“>”)。
Ⅱ、判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示
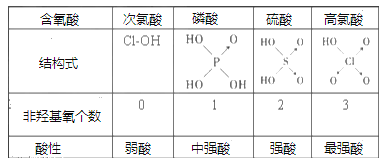
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3只有弱酸性。由此可推出亚磷酸的结构式为___________。从分子结构角度,简述二者酸性强弱原因_____________________。
(2)亚磷酸与过量的氢氧化钠溶液反应的化学方程式为:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用CO2重整CH4制合成气的反应为CO2(g)+CH4(g)![]() 2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:
容器 | 温度/℃ | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | |||
n(CO2) | n(CH4) | n(CO) | n(H2) | n(H2) | ||
Ⅰ | T1 | 0 | 0.8 | 0.8 | 0.8 | 0.6 |
Ⅱ | T1 | 1.2 | 1.2 | 1.2 | 1.2 | / |
Ⅲ | T2 | 1.0 | 2.0 | 0 | 0 | 1.0 |
Ⅳ | T2 | 0.5 | 1.0 | 0 | 0 | / |
下列说法正确的是( )
A. T1>T2
B. 容器Ⅱ起始时的反应速率:v(正)>v(逆)
C. 容器Ⅰ、Ⅲ达到平衡时,容器内气体总压强之比:p(Ⅰ)∶p(Ⅲ) =11∶20
D. 容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列各图均能表示甲烷的分子结构,按要求回答下列问题:

①上述哪一种更能反映其真实存在状况________ (填字母,下同)。
a.Ⅰ b.Ⅱ c.Ⅲ d.Ⅳ
②下列事实能证明甲烷分子是正四面体结构的是_____。
a.CH3Cl只代表一种物质 b.CH2Cl2只代表一种物质
c.CHCl3只代表一种物质 d.CCl4只代表一种物质
(2)烃分子中的碳原子与氢原子结合的方式是_____。
a.形成4对共用电子对
b.通过1个共价键
c.通过2个共价键
d.通过离子键和共价键
(3)乙烷的电子式为__________,分子式为CmH20的烷烃中m为________,分子式为C8Hn的烷烃中n为________,与CO2密度(同温同压)相同的烷烃分子式为____,若上述四种烃各为1mol,在足量O2中燃烧,消耗O2最多的是_____。
(4)若CH4、C2H6、C3H8、C4H10四种烃各为1g,在足量O2中燃烧,消耗O2最多的是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有少量苯酚稀溶液的试管中逐滴加入饱和溴水,产生白色沉淀 | 苯酚与Br2反应生成2,4,6三溴苯酚 |
B | 向H2O2溶液中滴入NaClO溶液,产生无色气体 | H2O2具有氧化性 |
C | 向FeCl3溶液中滴入少量KI溶液,再加入KSCN溶液,溶液变红 | Fe3+与I-的反应具有可逆性 |
D | 向蔗糖中滴加少量浓硫酸,搅拌,蔗糖变黑,体积膨松,变成疏松多孔的海绵状 | 浓硫酸具有脱水性和氧化性 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体的物质的量浓度随时间变化的情况。

试回答下列问题:
(1)该反应的化学方程式为________。
(2)0~t1s内气体B的平均反应速率为________。
(3)(t1+10)s时,B的物质的量分数为______,此时v正(A)_____v逆(B)(填“>”“<”或“=”),D点是否处于平衡状态_________(填“是”或“否”)。
(4)下列关于该反应的说法正确的是________ (填序号)。
a.到达t1时刻该反应已停止
b.在t1时刻之前,气体B的消耗速率大于它的生成速率
c.在t1时刻,气体C的正反应速率等于逆反应速率
(5)容器中(t1+10)s时的压强与起始时的压强之比为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com