
科目: 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
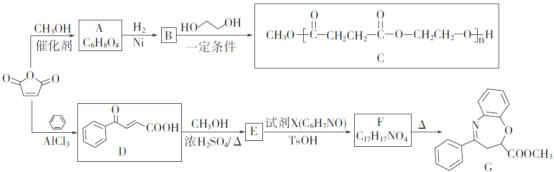
已知: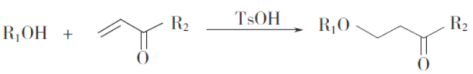
(1)A含有的官能团名称是______________。
(2)D→E的反应类型是_____________________。
(3)E的分子式是____________;F的结构简式是_________________。
(4)B→C的化学方程式为________________________________________。
(5)W是B的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44g CO2,W共有______种(不考虑立体异构),其中核磁共振氢谱为三组峰的结构简式为___________。
(6)设计由甲苯和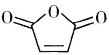 为原料制备化合物
为原料制备化合物![]() 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)基态Ga原子中有_____种能量不同的电子,其价电子排布式为_________。
(2)第四周期的主族元素中,基态原子未成对电子数与镓相同的元素有_______(填元素符号)。
(3)三甲基镓[(CH3)3Ga]是制备有机镓化合物的中间体。
①在700℃时,(CH3)3Ga和AsH3反应得到GaAs,化学方程式为____________________。
②(CH3)3Ga中Ga原子的杂化方式为__________;AsH3的空间构型是________________。
(4)GaF3的熔点为1000℃,GaC13的熔点为77.9℃,其原因是_______________________。
(5)砷化镓是半导体材料,其晶胞结构如图所示。
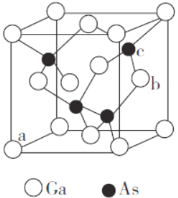
①晶胞中与Ga原子等距离且最近的As原子形成的空间构型为_______。
②原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中a(0,0,0)、b(1,![]() ),则c原子的坐标参数为______________。
),则c原子的坐标参数为______________。
③砷化镓的摩尔质量为M g·mol-1,Ga的原子半径为p nm,则晶体的密度为____g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
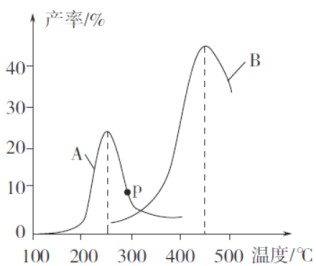
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。
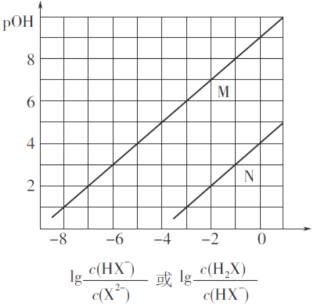
下列叙述正确的是
A. 曲线N表示pOH与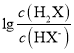 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
查看答案和解析>>
科目: 来源: 题型:
【题目】利用微生物燃料电池进行废水处理,实现碳氮联合转化。其工作原理如下图所示,其中M、N为厌氧微生物电极。
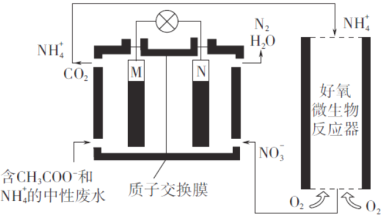
下列有关叙述错误的是
A. 负极的电极反应为CH3COO-—8e-+2H2O==2CO2↑+7H+
B. 电池工作时,H+由M极移向N极
C. 相同条件下,M、N两极生成的CO2和N2的体积之比为3:2
D. 好氧微生物反应器中发生的反应为NH3+2O2==NO3-+2H++H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
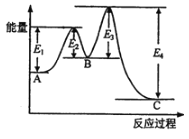
A. A→C的反应为放热反应 B. 稳定性C>A>B.
C. A→C的反应中,△H=(E2+E4)-(E1+E3) D. 加入催化剂不会改变反应的焓变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物1-氧杂-2,4-环戊二烯(![]() )的说法正确的是
)的说法正确的是
A. 与![]() 互为同系物B. 二氯代物有3种
互为同系物B. 二氯代物有3种
C. 所有原子都处于同一平面内D. 1mol该有机物完全燃烧消耗5molO2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以钒炉渣(主要含V2O3,还有少量SiO2、P2O5等杂质)为原料可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产工艺流程如下。
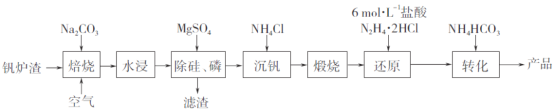
(1)焙烧过程中V2O3转化为可溶性NaVO3,该反应的化学方程式为_________________________________。
(2)滤渣的主要成分是________________(写化学式)。
(3)“沉钒”得到偏钒酸铵(NH4VO3),若滤液中c(VO3-)=0.1mol·L-1,为使钒元素的沉降率达到98%,至少应调节c(NH4+)为____mol·L-1。[已知Ksp(NH4VO3)=1.6×10-3]
(4)“还原”V2O5过程中,生成VOC12和一种无色无污染的气体,该反应的化学方程式为_______________________。用浓盐酸与V2O5反应也可以制得VOC12,该方法的缺点是____________________________。
(5)称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知滴定反应为VO2++Fe2++2H+==VO2++Fe3++H2O)
①KMnO4溶液的作用是______________。
②粗产品中钒的质量分数表达式为________(以VO2计)。
③若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果_____(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)玻璃中含有B,刻蚀玻璃的化学方程式为___。
(2)沉淀C的成分是___,溶液D中存在较多的阴离子是___。
(3)步骤③所加入的试剂是___,生成沉淀F的离子方程式是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.1H2、2H2、3H2互称同位素
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.同一周期(第一周期除外)的元素,从左到右由金属逐渐过渡到非金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com