
科目: 来源: 题型:
【题目】下列解释相关的离子方程式错误的是
A. H2S溶于水:H2S+H2O![]() HS-+H3O+
HS-+H3O+
B. 向Na2S2O3溶液中加入稀硫酸:S2O3-+2H+=S↓+SO2↑+H2O
C. NH4Cl溶液呈酸性:NH4++H2O=NH3·H2O+H+
D. K2Cr2O7溶于水:Cr2O7-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物的“价-类”二维图如下:

(1)写出X、Y的化学式:____________、____________
(2)某小组设计实验对硫燃烧的产物及其性质进行验证,实验装置如下图所示。(胶头滴管中为氯化钡溶液)

a.湿润的蓝色石蕊试纸
b.湿润的品红试纸
c.湿润的Na2S试纸
将硫粉点燃后伸入瓶中盖紧胶塞。
①湿润的Na2S试纸上出现淡黄色固体,说明硫的燃烧产物有___________性。
②湿润的品红试纸褪色说明了__________(填化学式)有__________性。
③湿润的蓝色石蕊试纸变红的原因____________________(用化学方程式表示)
④滴入氯化钡溶液,出现少量白色沉淀,写出白色沉淀的化学式____________。
(3)从“价-类”二维的角度,分析Z可能的化学性质:
①从物质类别的角度具有________的通性。
②从化合价的角度具有_________________________________________。
(4)根据二维图探究硫元素转化时,某同学预测出如下转化:2H2O+2S+3O2=2H2SO4,请问该同学分析物质转化缺少的思维角度是:__________。(填字母序号)
a.物质类别角度 b.化合价角度 c.化合价及类别两个角度
查看答案和解析>>
科目: 来源: 题型:
【题目】原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入稀硫酸中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_________________。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,若将该反应原理设计成原电池,请写出原电池的正极反应______________________________。
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示,测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

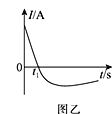
t1s前,原电池的负极是铝片,正极的电极反应式为________,溶液中的H+向______(填“正”或“负”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,A、B、C含有相同元素甲,一定条件下可以发生如下转化(水参与的反应,水未标出)。
![]()
(1)符合上述转化关系的A、X、B、C为____________________(填字母代号)
a.NaOHCO2Na2CO3NaHCO3 b.NaO2Na2ONa2O2
c.NH3 O2 NO NO2 d.FeCl2 FeCl2 FeCl3
(2)X为无色无味能使澄清石灰水变浑浊的气体,则C为_________________(填化学式)。若B中混有少量C杂质,除杂的化学方程式为_________________。
(3)C为红棕色气体,则A是_______或________(填化学式),若A的水溶液显碱性,写出A→B的化学方程式______________________________,B和C可相互转化,写出C→B的化学方程式_____________________________。
(4)若C为淡黄色固体,则B为___________,写出C在潜水艇中作为供氧剂牵涉的两个反应方程式__________、________。
(5)除(1)涉及的转化外,再写出一组符合转换关系的A、X、B、C ____ (填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。
(1)该反应中氧化剂是____________ ,氧化产物是____________。用单线桥表示反应的电子转移__________________。
(2)从反应可以看出氧化性:Cl2___________N2(填“>” “<”“=” )。若71g氯气参与反应,理论上生成N2的体积(标准状况)为_________________L(保留小数点后一位)。工作人员通过能否看到白烟判断管道是否漏气,请结合上述反应,写出生成的白烟的化学式______________。
Ⅱ.实验室现需配制100 mL 0.1mol/L的氢氧化钠溶液,请将步骤补充完整
计算可得需要氢氧化钠的质量为_____________ g。
将称量好的固体放入小烧杯中,加适量蒸馏水溶解;
将所得溶液冷却至室温后,沿玻璃棒小心转入100 mL_________(填仪器名称)
用少量蒸馏水烧杯2~3次,每次洗涤液都转入容量瓶中;
继续加蒸馏水至液面距刻度线1~2cm处,改用____________小心滴加蒸馏水至刻度线处;摇匀;装瓶,贴标签。
查看答案和解析>>
科目: 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
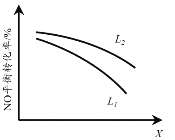
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。
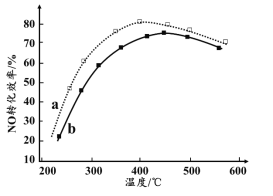
① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】请将下列物质与其对应的性质或用途连线。
物质与性质 | 物质与用途 |
SO2 黄色固体 NO2 黄绿色气体 Cl2 红棕色气体 S 无色气体 | 氨气 发酵粉 过氧化钠 漂白粉 碳酸氢钠 制冷剂 次氯酸钙 供氧剂 |
__________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Fe3O4可用于以太阳能为热源分解水制H2,过程如下图所示。下列说法正确的是:

A.过程Ⅰ的反应为6FeO+O2![]() 2Fe3O4
2Fe3O4 ![]()
B.过程Ⅱ中H2为还原剂
C.整个过程的总反应为:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.FeO是过程Ⅰ的氧化产物
查看答案和解析>>
科目: 来源: 题型:
【题目】研究铜和铁与浓硫酸的反应,实验如下:
① | ② |
| |
铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 | 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色 |
下列说法正确的是
A. 常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸
B. ②中铜丝或铁丝均有剩余时,产生气体的物质的量相等
C. 依据②,可推断出铜和铁与浓硫酸反应可生成SO2
D. ①②中现象的差异仅是由于温度改变了化学反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com