
科目: 来源: 题型:
【题目】下列有关说法正确的是 ( )
A. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B. 所有的化学反应都需要一定的活化能来推动
C. CH3COOH 溶液加水稀释后,溶液中![]() 的值增大
的值增大
D. Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知溶液中的化学反应大多是离子反应。根据要求回答下列问题。
(1)水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________(填 “左”或“右”)移动, 且所得溶液显____ 性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________(填 “左”或“右”)移动, 且所得溶液显____ 性。
(2)向水中加NaHCO3固体,水的电离平衡向____(填“左”或“右”)移动,且所得溶液显____ 性。
(3)常温下,0.1 mol·L-1 CH3COONa溶液的pH为9,则由水电离出的c(H+)=________。
(4)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍后pH仍相等,则m____n ( 填“>”“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是当今世界上最重要的化工产品之一,硫酸在生产中具有广泛的应用。
(1)某同学用如图所示的装置,完成铜与浓硫酸反应的实验:

①试管II中的现象是___。
②试管Ⅰ中发生反应的化学方程式是___。
③请你指出该实验装置的不足之处___。
(2)在实际应用中,人们常根据需要,把浓硫酸稀释成不同浓度的稀硫酸。现用18.4mol·L-1的浓H2SO4配制100mL1.00mol·L-1的稀H2SO4。
①用量筒量取浓硫酸的体积是___mL。
②下列操作会使所配溶液浓度偏低的是___。
A.将溶液转移到未干燥的容量瓶中
B.转移时,忘记洗涤烧杯和玻璃棒
C.将未冷却的溶液转移到容量瓶中
D.定容时,仰视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g)![]() CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度b.加入催化剂 c.减小CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为____,其原子核外有_____种不同运动状态的电子,基态Mn3+含有的未成对电子数是_____。
(2)CH3COOH中碳原子的杂化形式为___。CH3COOH能与H2O以任意比互溶的原因是____。
(3)NO3-的空间构型是__,与NO3-互为等电子体的分子的化学式是____(任写一种)。
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___,晶胞密度p为___gcm3。伏伽德罗常数的数值用NA表示)
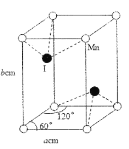
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)浩瀚的大海蕴藏着丰富的资源,从海水中可以获得很多化学物质。海水晒盐得到___,氯碱工业的产品有氯气、___、___。
(2)以下物质中:①葡萄糖;②氧化钠;③氯化镁溶液;④液态氯化氢,其中属于电解质的是___。
(3)15.6gNa2X含有0.2molX2-,含有Na+的物质的量是___mol,Na2X的摩尔质量为___g·mol-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】滴定分析法又叫容量分析法,是一种重要的定量分析法。酸碱中和滴定是重要的滴定分析实验。
(1)现用已知浓度的NaOH溶液,用中和滴定法去测定未知浓度的CH3COOH溶液,实验步骤如下,请填写有关内容:
① 将酸式滴定管洗净后,每次用3~4 mL待测醋酸溶液润洗2~3次,然后加入待测醋酸至0刻度以上。把滴定管夹在滴定管夹上,转动活塞,放出少量溶液,使滴定管________,并使液面达到________,记录初始读数。
② 用相似的方法在碱式滴定管中加入标准NaOH溶液,并调节好液面。
③ 在酸式滴定管内取V mL的待测醋酸移到洗净的锥形瓶中,加2~3滴________作指示剂。
④ 用标准NaOH溶液滴定待测醋酸。左手________,向锥形瓶中慢慢滴加NaOH溶液,右手轻轻摇动锥形瓶,两眼注视________,当溶液颜色由无色变为粉红色,且半分钟内不褪色,表示达到滴定终点,记录终点读数。
⑤ 重复上述实验步骤。
(2) 指示剂的选择一般根据滴定突跃,其选择标准是________。
(3) 已知标准NaOH溶液的浓度为0.1000 mol·L-1,所取待测醋酸的体积V均为20.00 mL。实验过程记录的数据如下表,求待测醋酸的物质的量浓度________。
滴定前 | 第一次 终点 | 第二次 终点 | 第三次 终点 | |
碱式滴定管 液面刻度 | 0.10 mL | 19.12 mL | 18.15 mL | 19.08 mL |
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时用0.10mol/L的KOH溶液滴定20.00mL0.10 mol/L的H2C2O4溶液,滴定过程中溶液的pH随KOH溶液体积变化如图所示(忽略滴定过程中溶液的温度变化和体积变化),下列说法错误的是( )
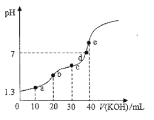
A. 25℃时H2C2O4的电离常数Ka1=10-1.6
B. b点满足关系:c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
C. c点溶液中粒子浓度大小顺序:c(K+)>c(C2O42-)>c(HC2O4)>c(H2C2O4)
D. 从a点到e点水的电离程度逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某澄清透明溶液可能含有Na+、Cl-、CO32-、SO42-、Mg2+、NH4+中的几种,进行如下实验:将上述溶液分为两等份,其中一份滴加足量的BaCl2溶液,得到白色沉淀4.66g;另一份溶液中滴加足量的NaOH溶液,得到0.58g白色沉淀,加热后产生标准状况下的气体0.224L,该气体能使湿润的红色石蕊试纸变蓝色。下列说法正确的是( )
A.溶液中可能有Na+、Cl-
B.溶液中一定没有Cl-、CO32-
C.溶液中一定有Na+、SO42-、Mg2+、NH4+
D.溶液中是否存在Na+只能用焰色反应确认
查看答案和解析>>
科目: 来源: 题型:
【题目】液态金属储能电池是一类成本较低的储能电池,其主体结构由三层密度不同的液体构成,上下两层液态金属分别作为电池两极,中间层的熔融盐在充放电过程中组成均保持不变。某种液态金属储能电池的结构如图所示,下列说法错误的是( )

A. 该电池放电过程中钠电极发生氧化反应
B. 该电池充电时锌电极发生的反应是Zn-2e-=Zn2+
C. 该电池的缺点是需要较高的工作温度
D. 该电池充电时电子由电源的负极经导线移向钠电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com