
科目: 来源: 题型:
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析正确的是

A. d点所示溶液中:c(NH4+)═2c(SO42)
B. C点所示溶液中:c(H+)c(OH)═2c(NH3·H2O)
C. NH3·H2O的电离常数K=104
D. V=40
查看答案和解析>>
科目: 来源: 题型:
【题目】利多卡因盐酸盐(F)是一种酰胺类局麻药,对中枢神经系统有明显的兴奋和抑制双相作用,其合成路线如下图所示,请回答相关问题。
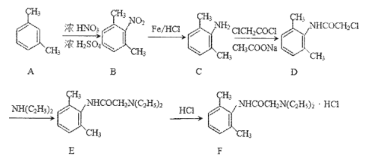
(1)A的系统名称是_____,D中的官能团名称是___。
(2)F的化学式是_____。
(3)B—C、D—E的反应类型依次是_____、_____。
(4)D与足量NaOH溶液加热充分反应的方程式是_____。
(5)G物质是比B多一个碳原子的同系物,符合下列要求的G的同系物有___种(不考虑立体异构),其中核磁共振氢谱有六组峰且面积比为3:2:2:2:1:1的结构简式是____(任写一种)。______
I.苯环上有两个取代基且其中一个不含碳原子 II.含有一COO—结构
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。将15.8gKMnO4与足量的浓盐酸充分反应,产生气体的体积均在标准状况下测定,请计算:
(1)高锰酸钾的物质的量是___mol。
(2)产生的Cl2的体积是___L。
(3)若用MnO2与足量的浓盐酸反应制取相同体积的Cl2,理论上需要MnO2的质量是___克。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为从海带中提取碘的工业生产过程图,按照要求回答问题:

(1)海水中碘的总藏量很大,目前工业上___(填“直接”或“不直接”)用海水提取碘。
(2)工业生产过程中通常将干海带粉碎的目的是___。
(3)“滤液”中加入硫酸酸化的离子方程式是___;“氧化”步骤发生反应的离子方程式是___。
(4)生产过程图中“提纯”的方法是___。
(5)下列有关从海带中提取碘的说法错误的是___。
A.“过滤”操作若在实验室进行,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒
B.“碱化”时加入NaOH溶液的主要作用是可溶性有机质在碱性溶液中可形成沉淀
C.现在工业上从海带中提取碘时,也有用离子交换法处理含碘离子的溶液以提高碘的提取率
D.可用淀粉溶液检验“滤液”中的离子是否氧化完全
查看答案和解析>>
科目: 来源: 题型:
【题目】图中,固体A是铁锈的主要成分。
![]()
请回答:
(1)固体C的化学式是___,上述框图中体现了SO2的___(填“氧化性”、“还原性”或“漂白性”)。
(2)写出A→B的化学方程式___。
(3)写出D→E的离子方程式___。
(4)若通入的SO2是足量的,请你设计实验方案检验“溶液D”中的金属阳离子___。
查看答案和解析>>
科目: 来源: 题型:
【题目】磺酰氯(SO2C12)是有机合成领域常用的氯化剂、磺化剂、氯磺化剂,熔点-54.1℃,沸点69.1℃,在潮湿空气中会产生酸雾,高温下容易分解。某化学小组用下图所示装置制取磺酰氯,反应原理是:SO2(g)+C12(g)=SO2C12 (1)△H=-97.3kJ/mol,请回答相关问题。

(1)仪器组装好以后首先要进行的操作是____。
(2)装置E的仪器名称是___,所装药品是____。
(3)若缺少装置B,三颈烧瓶中会发生的主要副反应化学方程式是____(任写一个)。装置B更换为某装置后可起到同样的作用,该装置可以是____。
(4)通过气体流量计测得通入Cl2的体积折合成标准状况为3.36L(SO2足量),最终得到的SO2C12质量为8.1g,则产率___。下列措施能提高SO2C12产率的是___。(填选项序号)
a.加快通入氯气的速率
b.三颈烧瓶温度过高时适当冷却
c.先打开分液漏斗活塞并通入氯气再通入冷凝水
(5)某同学在实验过程中不小心将SO2C12与H2SO4混合在一起,分离该混合物的方法是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
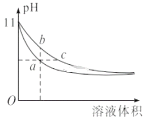
A. a点导电能力比b点强
B. a、c两点的c(H+)相等
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. b点的Kw值大于c点
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应N2+3H2![]() 2NH3,达到平衡时,3v正(H2)=2v正(NH3)
2NH3,达到平衡时,3v正(H2)=2v正(NH3)
B. 25℃时,0.1 mol/L的NaHB溶液呈酸性,说明H2B为强酸
C. 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3H2O)变小
D. 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 向K2Cr2O4溶液中滴入浓的NaOH溶液后,溶液黄色加深
B. 高压比常压更有利于合成SO3
C. 反应2SO2+O2![]() 2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目: 来源: 题型:
【题目】NF3是微电子工业中常用的一种等离子蚀刻气体,具有较强的氧化性,工业生产NF3常用的方法有气一液反应法、气一固反应法和电解法等。
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=_____。部分键能数据如下表所示,△H3=_____kJ/mol。
化学键 | N-N | N=N | N | H-F | F-F | N-H | N-F |
键能(kJ/mol) | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
反应I的平衡常数K1和反应II的平衡常数的关系是___。若在恒温、恒容的密闭容器中模拟气一固反应法(固体足量),起始时F2的浓度为5mol/L,反应过程中容器中压强一随时间变化曲线如图所示,则前2min的平均反应速率v(NF3)=___mol/(Lmin),该温度下K2=___。
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的____(填“正极”或“负极”),生成气体A的电极反应是____。
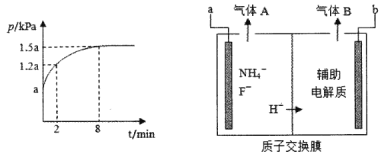
(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是_____。(用化学用语解释)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com