
科目: 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
查看答案和解析>>
科目: 来源: 题型:
【题目】使用磷肥副产物氟硅酸钠(Na2SiF6)为原料合成冰晶石(Na3AlF6)成为一条合理利用资源、提高经济效益的新方法。工艺流程如下图所示:
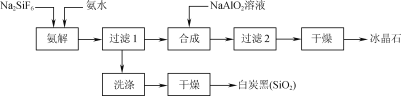
(1)传统合成冰晶石的方法是萤石(CaF2)法:使用萤石、石英和纯碱在高温下煅烧生成NaF,在NaF溶液中加入Al2(SO4)3溶液制得。在加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,
否则可能产生副产物____(填物质的化学式),但酸度不宜过强的原因是____。
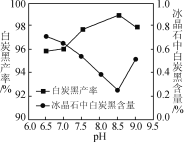
(2)氨解时白炭黑产率和冰晶石纯度与pH的关系如图,氨解时需要控制溶液的pH=____;能提高氨解速率的措施有____(填字母)。
A.快速搅拌
B.加热混合液至100℃
C.减小氨水浓度
(3)工艺流程中氨解反应的化学方程式为____;冰晶石合成反应的离子方程式为______。
(4)为了提高原料利用率,减少环境污染,可采取的措施是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是( )

A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有![]()
C.该有机物分子中的所有原子在同一平面上
D.该有机物可以由乙烯和氯化氢加成反应得到
查看答案和解析>>
科目: 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH4+):③>①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】H(3一溴-5-甲氧基苯甲酸甲酯)是重要的有机物中间体,可以由A(C7H8)通过下图路线 合成。

请回答下列问题:
(1)C的化学名称为________,G中所含的官能团有醚键、_______、__________(填名称)。
(2)B的结构简式为________,B生成C的反应类型为___________。
(3)由G生成H的化学方程式为_________。E→F是用“H2/Pd”将硝基转化为氨基,而C→D选用的是(NH4)2S,其可能的原因是________。
(4)化合物F的同分异构体中能同时满足下列条件的共有________种。
①氨基和羟基直接连在苯环上 ②苯环上有三个取代基且能发生水解反应
(5)设计用对硝基乙苯 为起始原料制备化合物
为起始原料制备化合物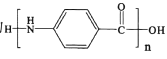 的合成路线(其他试剂任选)。_____
的合成路线(其他试剂任选)。_____
查看答案和解析>>
科目: 来源: 题型:
【题目】由乙烯推测丙烯的结构或性质,正确的是( )
A.分子中3个碳原子在同一直线上
B.分子中所有原子都在同一平面上
C.分子中共价键的夹角均为120°
D.分子中共价键数为8,其中有一个碳碳双键
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某化学研究性学习小组在实验室制备NaClO溶液,并进行性质探究和成分测定。

(1)该学习小组按上图装置进行实验(部分夹持装置省去),反应一段时间后,分别取B、C瓶中的溶液进行实验,实验现象如下表。
已知:①饱和NaClO溶液pH为11;
②25°C时,弱酸电离常数为:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:K=3×10-8
实验步骤 | 实验现象 | |
B瓶 | C瓶 | |
实验1:取样,滴加紫色石蕊试液 | 变红,不褪色 | 变蓝,不褪色 |
实验2:测定溶液的pH | 3 | 12 |
回答下列问题:
①仪器a的名称___________,装置A中发生反应的离子方程式__________。
②C瓶溶液中的溶质是NaCl、__________(填化学式)。
③若将C瓶溶液换成NaHCO3溶液,按上述操作步骤进行实验,C瓶现象为:实验1中紫色石蕊试液立即褪色;实验2中溶液的pH=7.结合平衡移动原理解释紫色石蕊试液立即褪色的原因______
(2)测定C瓶溶液中NaClO含量(单位:g/L)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液,淀粉溶液显示终点后,重复操作2~3次,Na2S2O3溶液的平均用量为24.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤I的C瓶中发生反应的离子方程式为_________。
②盖紧瓶塞并在暗处反应的原因__________滴定至终点的现象_____________。
③C瓶溶液中NaClO含量为______g/L(保留2位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol/L,则此时v正____v逆(填“大于”“小于”或“等于”)。
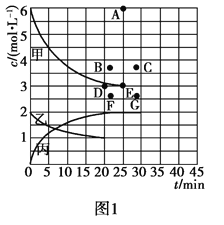
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是______。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。
![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图2所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图2所示:
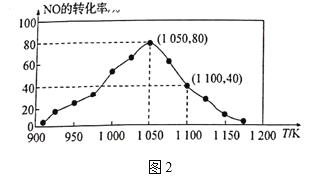
①由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为__________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=______[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
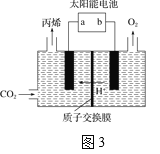
(4)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如图3所示
①太阳能电池的负极是_______(填“a”或“b”)
②生成丙烯的电极反应式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
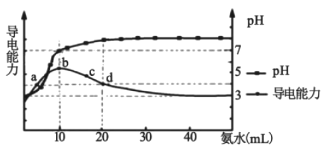
A. 各点溶液中的阳离子浓度总和大小关系:d>c>b>a
B. 常温下,R- 的水解平衡常数数量级为10 -9
C. a点和d点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D. Kw/c(H+)=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com