
科目: 来源: 题型:
【题目】一种新型锰氢二次电池原理如图所示。该电池以MnSO4溶液为电解液,碳纤维与Pt/C分别为电极材料,电池的总反应为Mn2++ 2H2O![]() MnO2 + 2H++ H2↑。下列说法错误的是
MnO2 + 2H++ H2↑。下列说法错误的是
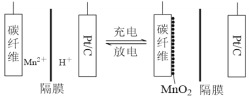
A. 充电时,碳纤维电极做阳极
B. 充电时,碳纤维电极附近溶液的pH增大
C. 放电时,电子由Pt/C电极经导线流向碳纤维电极
D. 放电时,正极反应式为MnO2 + 4H++ 2e-=Mn2++ 2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在2L的密闭容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为______。
②若X、Y、Z均为气体,2min时反应达到平衡,此时体系内压强与开始时的压强之比为____。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时__(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是
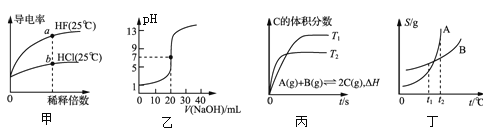
A. 由图甲可知,![]() 点Kw的数值比
点Kw的数值比![]() 点Kw的数值大
点Kw的数值大
B. 乙表示![]()
![]() 溶液滴定
溶液滴定![]()
![]() 醋酸溶液的滴定曲线
醋酸溶液的滴定曲线
C. 丙表示在相同的密闭容器中,不同温度下的反应,该反应的![]()
D. 丁表示![]() 、
、![]() 两物质的溶解度随温度变化情况,将
两物质的溶解度随温度变化情况,将![]() 时
时![]() 、
、![]() 的饱和溶液分别升温至
的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列有关说法正确的是
A. 常温常压下,31 g P4中含P-P键的数目为NA
B. 常温常压下,46 g NO2与92 g N2O4所含的分子数相同
C. 一定条件下,6.4 g铜粉与过量的硫粉充分反应,转移电子数为0.2 NA
D. 标准状况下,将22.4 L Cl2 通入足量NaOH溶液中,转移电子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿的主要成分是FeWO4、MnWO4,还含有少量Si、P、As的化合物。由黑钨矿制备WO3的工艺流程如图:
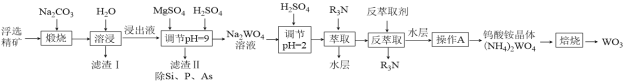
已知:①滤渣I的主要成份是Fe2O3、Mn3O4。
②萃取剂为叔胺N235,化学式用R3N表示,是一种弱碱。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价是_________,“煅烧”过程中生成Mn3O4的化学方程式是________________________________________________。
(2)溶浸时,固体要进行粉碎,同时还要不断搅拌的目的是______________________________。
(3)浸出液中的溶质有Na2WO4、Na2SiO3、Na3PO4、Na3AsO4,加入MgSO4、H2SO4将溶液的pH调至9时,溶液中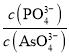 =_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
=_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
(4)“调节pH=2”时,钨酸钠(Na2WO4)转化为偏钨酸钠(Na6H2W12O40)的离子方程式是
12WO42-+ 18H+![]() H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)
H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)![]() (R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
(R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
A.氨水 B.NaOH溶液 C.NH4HCO3溶液 D.NH4Cl溶液
(5)操作A的名称是__________,焙烧生成WO3的化学方程式是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F位于同一周期,三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试回答:
(1)写出下列元素的元素符号:
A_____,C_____,D_____,E__________
(2)用电子式表示B、F形成的化合物_____。
(3)A、C两种元素最高价氧化物的水化物之间反应的化学方程式为_____, C、F两种元素最高价氧化物的水化物之间反应的离子方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe(OH)3广泛应用于医药制剂、颜料制造等领域,其制备步骤及装置如下:在三颈烧瓶中加入16.7gFeSO4·7H2O和40.0ml蒸馏水。边搅拌边缓慢加入3.0mL浓H2SO4,再加入2.0gNaClO3固体。水浴加热至80℃,搅拌一段时间后,加入NaOH溶液,充分反应。经过滤、洗涤、干燥得产品。
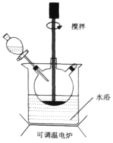
(1)NaClO3氧化FeSO4·7H2O的离子方程式为_____________。
(2)加入浓硫酸的作用为_________(填标号)。
a.提供酸性环境,增强NaClO3氧化性 b.脱去FeSO4·7H2O的结晶水
c.抑制Fe3+水解 d.作为氧化剂
(3)检验Fe2+已经完全被氧化需使用的试剂是_________。
(4)研究相同时间内温度与NaClO3用量对Fe2+氧化效果的影响,设计对比实验如下表
编号 | T/℃ | FeSO4·7H2O/g | NaClO3/g | 氧化效果/% |
i | 70 | 25 | 1.6 | a |
ii | 70 | 25 | m | b |
iii | 80 | n | 2.0 | c |
iv | 80 | 25 | 1.6 | 87.8 |
①m=______;n=______。
②若c>87.8>a,则a、b、c的大小关系为___________。
(5)加入NaOH溶液制备Fe(OH)3的过程中,若降低水浴温度,Fe(OH)3的产率下降,其原因是___
(6)判断Fe(OH)3沉淀洗涤干净的实验操作为_________________;
(7)设计实验证明制得的产品含FeOOH(假设不含其他杂质)。___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列五种物质中①Ne;②H2O;③NH3;④KOH;⑤Na2O,只存在共价键的是____,只存在离子键的是____,既存在共价键又存在离子键的是____,不存在化学键的是_____.(填写序号)
(2)现有①Na2S、②NH4Cl、③干冰、④碘片四种物质,按下列要求回答:
用电子式表示①的形成过程是_______,用电子式表示④的形成过程是___________②的电子式是________③的电子式是__________
查看答案和解析>>
科目: 来源: 题型:
【题目】由A和C为原料合成治疗多发性硬化症药物H的路线如下:
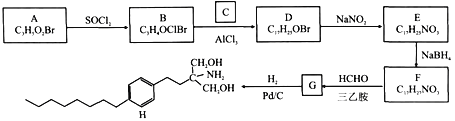
已知:
①A能与NaHCO3溶液反应放出CO2,其核磁共振氢谱显示有三组峰,峰面积比为2:2:1。
②NaBH4能选择性还原醛、酮,而不还原—NO2。

回答下列问题:
(1)A的化学名称为________,D的结构简式为_______。
(2)H的分子式为_______,E中官能团的名称为_______。
(3)B→D、E→F的反应类型分别为_______。
(4)F→G的化学方程式为________。
(5)与C互为同分异构体的有机物的结构简式为_______(核磁共振氢谱为四组峰,峰面积比为6:3:1:1)。
(6)设计由B和![]() 为原料制备具有抗肿瘤活性药物
为原料制备具有抗肿瘤活性药物 的合成路线__________。
的合成路线__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com