
科目: 来源: 题型:
【题目】在20世纪90年代末期,科学家发现并证明碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关说法错误的是

A. 熔点比较: ![]()
B. ![]() 、
、![]() 、管状碳和洋葱状碳之间的转化属于化学变化
、管状碳和洋葱状碳之间的转化属于化学变化
C. ![]() 晶体结构如上图所示,每个
晶体结构如上图所示,每个![]() 分子周围与它最近且等距离的
分子周围与它最近且等距离的![]() 分子有12个
分子有12个
D. ![]() 、
、![]() 、管状碳和洋葱状碳都不能与
、管状碳和洋葱状碳都不能与![]() 发生反应
发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
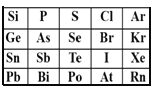
A. 稳定性:HBr<HI<Hat
B. 酸性:H3PO4<H2SO4<HClO4
C. 原子半径:Sn>As>S
D. 表中,元素Pb的金属性最强
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅹ、Y、Z、W、M五种元素的原子序数依次增大。已知Ⅹ、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是
A. 原子半径:r(M)>r(Y)>r(Z)>r(W)>r(X)
B. W和M形成的化合物不能与强碱反应
C. Ⅹ、Z、W三元素所形成的化合物一定为共价化合物
D. Y、Z的最高价含氧酸的酸性:Y>Z
查看答案和解析>>
科目: 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:

请回答下列问题:
(1)A的化学名称为______;C中官能团的名称是_______。
(2)③的反应试剂和反应条件分别是_______,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________
(4)反应④的化学方程式为__________
(5)G的相对分子质量为__________。
(6)![]() 是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有___种。其中核磁共振氢谱上有4组峰且峰面积比为1:2:2:2的物质的结构简式为_____。
①![]() 直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体。
(7)参照上述合成路线,以CH3CH2COCl和![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]() 的路线为(其他无机试剂任选)_____。
的路线为(其他无机试剂任选)_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸四氨合铜晶体![]() 常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为____。
(2)某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因_____
II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
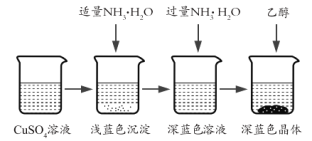
(3)已知浅蓝色沉淀的成分为![]() ,试写出生成此沉淀的离子反应方程式_________。
,试写出生成此沉淀的离子反应方程式_________。
(4)析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是__。
III.氨含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mL C1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。
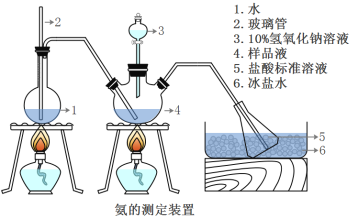
(5)A装置中长玻璃管的作用_____,样品中氨的质量分数的表达式_______。
(6)下列实验操作可能使氨含量测定结果偏低的原因是_______。
A.滴定时未用NaOH标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.滴定过程中选用酚酞作指示剂
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 第Ⅰ![]() 族元素的金属性比第Ⅱ
族元素的金属性比第Ⅱ![]() 族元素的金属性强
族元素的金属性强
B. 第Ⅵ![]() 族元素的简单气态氢化物中,稳定性最强的其沸点也最高
族元素的简单气态氢化物中,稳定性最强的其沸点也最高
C. 同周期非金属元素的氧化物对应的水化物的酸性从左到右依次增强
D. 第二周期元素随族序数的递增,其最高化合价也递增
查看答案和解析>>
科目: 来源: 题型:
【题目】砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为___。与砷同周期的主族元素的基态原子中,电负性最大的为____(填元素符号)。
(2)![]() 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______。
②其中阴离子的VSEPR模型为_____,与其互为等电子体的分子为_____(只写一种分子式即可)。
(3)M(![]() )可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
)可用于合成Ni2+的配体,M中C原子的杂化形式为______,σ键和π键的数目之比为_____。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为______。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______。
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为![]() ,该晶体的密度ρ=____g·cm-3。
,该晶体的密度ρ=____g·cm-3。

查看答案和解析>>
科目: 来源: 题型:
【题目】现有如下各种说法:
①金属和非金属化合时一定形成离子键;
②离子键是阳离子、阴离子的相互吸引力;
③根据电离方程式HCl![]() H++Cl-,判断氯化氢分子里存在离子键;
H++Cl-,判断氯化氢分子里存在离子键;
④氢气和氯气的反应过程:H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述各种说法正确的是
A. ①② B. 都不正确 C. ①②④ D. ①
查看答案和解析>>
科目: 来源: 题型:
【题目】将标准状况下2.24L CO2缓慢通入1L 0.15mol·L-1的NaOH溶液中,气体被充分吸收(溶液体积变化忽略不计),下列关系式不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】“循环经济”和“低碳经济”是目前备受关注的课题,因而对碳和硫的化合物的综合利用成为研究的热点。请回答下列问题:
(1)下列事实中,不能用来比较碳元素和硫元素非金属性强弱的是______(填选项字母)。
A.![]() 有漂白性而
有漂白性而![]() 没有
没有
B.少量![]() 能与
能与![]() 反应生成
反应生成![]()
C.![]() 能使酸性
能使酸性![]() 溶液褪色而
溶液褪色而![]() 不能
不能
D.![]() 溶液显碱性而
溶液显碱性而![]() 溶液显中性
溶液显中性
(2)下图是通过热循环进行能源的综合利用和污染治理的反应系统原理。

系统(Ⅱ)制氢气的热化学方程式为_________;两个系统制得等量的H2所需能量较少的是________。
(3)向10 L恒容密闭容器中充入2 mol CO和1 mol ![]() ,发生反应2CO(g)+SO2 (g)
,发生反应2CO(g)+SO2 (g)![]() S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
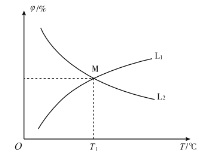
①图中能表示CO的平衡体积分数与温度关系的曲线为______(填“L1”或“L2”)。
②T1 ℃时,![]() 的平衡转化率α1=_______,反应的平衡常数
的平衡转化率α1=_______,反应的平衡常数![]() _________。
_________。
③只改变下列条件,既能加快该反应速率,又能增大CO的平衡转化率的是_____(填选项字母)。
A.增大压强 B.充入一定量![]()
C. 充入一定量![]() D.加入适当催化剂
D.加入适当催化剂
④向起始温度为![]() ℃的10 L绝热容器中充入2 mol CO和1 mol
℃的10 L绝热容器中充入2 mol CO和1 mol ![]() ,重复实验,该反应的平衡常数
,重复实验,该反应的平衡常数![]() _____
_____![]() (填“>”“<”或“=”),理由为_____。
(填“>”“<”或“=”),理由为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com