
科目: 来源: 题型:
【题目】(14分)以下四组装置在下列实验可供选择

Ⅰ.实验室用甲醇催化氧化法得到甲醛,并验证甲醛的性质。请回答下列问题:
(1)应选择的装置是___ _____(填写编号)。
(2)若③硬质玻璃管中装有铜粉,请写出硬质玻璃管中发生反应的化学方程式___________________
(3)实验结束后,观察到溴水褪色。为解释这一现象,某学习小组的同学提出两种猜想:
A. 发生了加成反应; B. 发生了氧化反应。
为探究哪种猜想正确,学习小组的同学用pH计测溴水褪色前后溶液的pH,测得溶液的pH下降,你认为发生何种反应,请说出你的理由________________ 。
Ⅱ.若选择①③②验证乙烯与氢气反应产物,请回答下列问题:
(4)写出实验室制乙烯的化学方程式_______________________________________。
(5)NaOH溶液的作用是(答两点即可)____________、_ 。
(6)实验过程中,发现③中溴水褪色,试用化学方程式表示溴水褪色的原因______________;
(7)出现什么现象可说明乙烯与氢气反应生成了乙烷 _____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电导率用于衡量电解质溶液导电能力的大小,与离子浓度和离子迁移速率有关。图1 为相同电导率盐酸和醋酸溶液升温过程中电导率变化曲线,图2 为相同电导率氯化钠和醋酸钠溶液升温过程中电导率变化曲线,温度均由22℃上升到70℃。下列判断不正确的是

A. 由曲线1可以推测:温度升高可以提高离子的迁移速率
B. 由曲线4可以推测:温度升高,醋酸钠电导率变化与醋酸根的水解平衡移动有关
C. 由图1和图2可以判定:相同条件下,盐酸的电导率大于醋酸的电导率,可能的原因是Cl-的迁移速率大于CH3COO-的迁移速率
D. 由图1和图2可以判定:两图中电导率的差值不同,与溶液中H+、OH-的浓度和迁移速率无关
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A可用作果实催熟剂。某同学欲以A为主要原料合成乙酸乙酯,其合成路线如图所示。
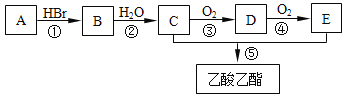
请回答:
(1)C分子中含有的官能团名称是___________; C的同分异构体的核磁共振氢谱只有一种类型氢原子的吸收峰,其结构简式是___________。
(2)反应①的反应类型是_________反应,反应 ②~⑤ 中反应类型相同的是_______和_______、_________和________(填序号)。
(3)由A可以直接转化为C,其反应的化学方程式是___________。
(4)反应②的化学方程式是____________,反应⑤的化学方程式是______。
(5)为了检验B中的溴元素,以下操作合理的顺序是________(填序号)。
a.加AgNO3 溶液 b.加NaOH 溶液 c.加热 d.加稀硝酸至溶液显酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.10mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是

A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中c(NH4+)>c(Cl-)
C. Q点消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的电离程度相同
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800 ℃,反应达到平衡时,NO的物质的量浓度是________。

(2)如图中表示NO2的变化的曲线是________。用NO2表示从0~2s内该反应的平均速率v=________。
(3)能说明该反应已达到平衡状态的是________。
a. v(NO2)=2v(O2) b. 容器内压强保持不变
c. 2v逆(NO)=v正(O2) d. 容器内气体的平均摩尔质量保持不变
(4)能使该反应的反应速率增大的是________。
a. 及时分离出NO2气体 b. 适当升高温度
c. 增大O2的浓度 d. 选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图。

(1)步骤①中除去粗盐中杂质(Mg2+、SO![]() 、Ca2+),加入的药品顺序正确的是__________。
、Ca2+),加入的药品顺序正确的是__________。
A. NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C. NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D. BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
(2)步骤⑤中已获得Br2,步骤⑥中又用SO2的水溶液将Br2吸收,其目的是___________。
(3)写出步骤⑥中发生反应的离子方程式:_______________。
(4)把溴吹入到SO2的水溶液的气体X最可能用下面的___(填序号)。
A. 乙烯 B. 空气 C. 氩气 D. CO2
(5)由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由弱到强的顺序是___________。
(6)钛是航空、军工、电力等方面的必需原料。常温下钛不与非金属、强酸反应,红热时,却可与常见的非金属单质反应。目前大规模生产钛的方法是:TiO2、炭粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体。该反应的化学方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A——F六种有机化合物是重要的有机合成原料,结构简式见下表,请根据要求回答下列问题:
化合物 | A | B | C |
结构简式 |
|
|
|
化合物 | D | E | F |
结构简式 |
|
|
|
(1)化合物A属于________类(按官能团种类分类)
(2)化合物B在一定条件下,可以与NaOH溶液发生反应,写出化合物B 与足量NaOH反应的化学方程式_____________。
(3)化合物C与D在一定条件下发生如图转化得到高分子化合物Z,部分产物已略去。

反应③中D与H2按物质的量1:1反应生成Y,则 生成Z的方程式为__________。
(4)化合物D与银氨溶液反应的化学方程式____________(有机物用结构简式表示):。
(5)写出符合下列条件的E的同分异构体的结构简式:_________。
A.苯环上只有一个取代基
B.能发生水解反应
C.在加热条件下能够与新制的氢氧化铜悬浊液生成砖红色沉淀
(6)化合物F是合成“克矽平”(一种治疗矽肺病的药物)的原料之一,其合成路线如下:(说明:克矽平中氮氧键是一种特殊的共价键;反应均在一定条件下进行。)
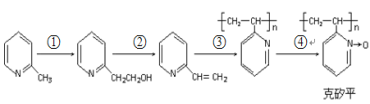
a.反应①是原子利用率100%的反应,则该反应的化学方程式为_____________;
b.上述转化关系中没有涉及的反应类型是(填代号)___________。
①加成反应 ②消去反应 ③还原反应 ④氧化反应 ⑤加聚反应 ⑥取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为_____________。
(2)由A、B、W三种元素组成的18电子微粒的电子式为______________。
(3)若要比较D与E的金属性强弱,下列实验方法可行的是____________。
A. 将单质D置于E的盐溶液中,若D不能置换出单质E,说明D的金属性弱
B. 比较D和E的最高价氧化物对应水化物的碱性,前者比后者强,故前者金属性强
C. 将D、E的单质分别投入到同浓度的盐酸中,观察到D反应更剧烈,说明D的金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com