
科目: 来源: 题型:
【题目】人们对含硼(元素符号为“B”)物质结构的研究,极大地推动了结构化学的发展。回答下列问题:
(1)基态B原子价层电子的电子排布式为_____,核外电子占据最高能层的符号是____,占据该能层未成对电子的电子云轮廓图形状为____。
(2)1923年化学家Lewis提出了酸碱电子理论。酸碱电子理论认为:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。已知BF3与F-反应可生成BF4-,则该反应中BF3属于____(填“酸”或“碱”),原因是____。
(3)NaBH4是有机合成中常用的还原剂,NaBH4中的阴离子空间构型是_____,中心原子的杂化形式为____,NaBH4中存在____(填标号)
a.离子键 b.金属键 c.σ键 d.π键 e.氢键
(4)请比较第一电离能:IB____IBe(填“>”或“<”),原因是_______。
(5)六方氮化硼的结构与石墨类似,B—N共价单键的键长理论值为158pm,而六方氮化硼层内B、N原子间距的实测值为145 pm,造成这一差值的原因是____。高温高压下,六方氮化硼可转化为立方氮化硼,立方氮化硼的结构与金刚石类似,已知晶胞参数中边长为a=362 pm,则立方氮化硼的密度是____g/cm3。

查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
I.(1)AlCl3的水溶液pH______7(填>、=、<=,其原因为______________(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是_____________________(填化学式)。
(2)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至_____________。
(3)物质的量浓度相同的三种溶液:①NH4Cl ②氨水 ③NH4HSO4,c(NH4+)大小顺序正确的是______________。(用序号表示)
(4)常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出C(H+)之比为____________________。
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
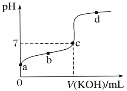
(1)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是___________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为___mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )
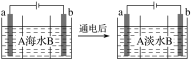
A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是( )
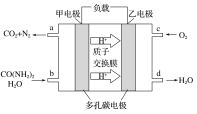
A. 电池工作时H+移向负极
B. 该电池用的电解质溶液是KOH溶液
C. 甲电极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+
D. 电池工作时,理论上每净化1 mol CO(NH2)2,消耗33.6 L O2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是:600℃ 时,在2L密闭容器里A、B、C三种气体在密闭容器中反应时浓度的变化,其中A为有色气体,B、C是无色气体。请从图中分析并填空:

(1)该反应的化学反应方程式为_____
(2)反应达到平衡状态时,反应物的转化率为_____
(3)当反应进行到第_____min,该反应达到平衡。
(4)反应从开始至2分钟末,B的物质的量_____,用B的浓度变化表示的平均反应速率为v(B)=_
(5)下列描述能表示反应达平衡状态的是_____(填选项)。
a.容器中A与B的物质的量相等
b.容器内气体的颜色不再改变
c.各物质的浓度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4Cl
(1)只由非极性键构成的物质是___(填编号,下同);
(2)由离子键和极性键构成的物质是___;
(3)属于共价化合物的物质是___;
(4)⑤H2O2的电子式为:___;
(5)用电子式表示⑥MgF2的形成过程:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
Ⅰ.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应①2NO(g)+ 2CO(g) N2(g) + 2CO2(g) ΔH1。
(1)已知:反应②N2(g)+O2(g) 2NO(g) ΔH2= +180.5 kJ·mol-1,CO的燃烧热为283.0 kJ·mol-1,则ΔH1=____。
(2)在密闭容器中充入5molCO和4molNO,发生上述反应①,图1为平衡时NO的体积分数与温度、压强的关系。

①温度:T1____T2(填“<”或“>”) 。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。若低于200℃,图2中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为______;a点_____(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由______。
II.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g) (快反应)
第二步I(g)+N2O(g) → N2(g)+IO(g) (慢反应)
第三步IO(g)+N2O(g) → N2(g)+O2(g)+I2(g) (快反应)
实验表明,含碘时N2O分解速率方程v = k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是____。
A.I2浓度与N2O分解速无关 B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的中间产物
查看答案和解析>>
科目: 来源: 题型:
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A.该电池工作时,每消耗![]()
![]() 转移3mol电子
转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,![]() 向电极B移动
向电极B移动
D.电极B上发生的电极反应为:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】用0.1 mol·L-1 NaOH溶液滴定40 mL 0.1 mol·L-1 H2SO3溶液,所得滴定曲线如图所示(忽略混合时溶液体积的变化)。下列叙述错误的是( )

A. Ka2(H2SO3)的数量级为10-8
B. 若滴定到第一反应终点,可用甲基橙作指示剂
C. 图中Z点对应的溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)
D. 图中Y点对应的溶液中:3c(SO32-)=c(Na+)+c(H+)-c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关热化学方程式的叙述,正确的是( )
A. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
B. 由N2O4(g)![]() 2NO2(g) ΔH=-56.9 kJ·mol-1,可知将1 mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9 kJ
2NO2(g) ΔH=-56.9 kJ·mol-1,可知将1 mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9 kJ
C. 由:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
D. 已知101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则1 mol碳完全燃烧放出的热量大于110.5 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com