
科目: 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C的原子半径在所有短周期主族元素中最大,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005 mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述一定正确的是
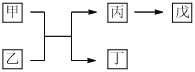
A. C、D两元素形成的化合物的原子个数比为1:2
B. C、E形成的化合物的水溶液呈碱性
C. 简单离子半径:D> C> B
D. 最高价氧化物对应水化物的酸性:E>A
查看答案和解析>>
科目: 来源: 题型:
【题目】I.根据如图给出的装置图回答下列问题:

(1)写出图中玻璃仪器的名称:①____;②____;③_____。
(2)①~④中,使用前必须检查是否漏水的是___、___(填仪器序号),分离溴水中的溴应先选择装置___(填Ⅰ、Ⅱ或Ⅲ序号)。
Ⅱ.某同学帮助水质检测站配制480mL0.5mol·L-1NaOH溶液备用。请回答下列问题:
(1)该同学用到的玻璃仪器有烧杯、量筒、玻璃棒、___、胶头滴管。
(2)该同学用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体,则称取的总质量为___克。
(3)配制时,其正确的操作顺序如下,请填充所缺步骤。
A.在盛有NaOH固体的烧杯中加入适量水溶解;
B.将烧杯中冷却的溶液沿玻璃棒注入容量瓶中;
C.用少量水___2次~3次,洗涤液均注入容量瓶,振荡。
D.继续往容量瓶内小心加水,直到液面接近刻度___处,改用胶头滴管加水,使溶液___。
E.将容量瓶盖紧,反复上下颠倒,摇匀。
(4)若出现如下情况,其中将引起所配溶液浓度偏低的是____(填编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤C ④加蒸馏水时不慎超过了刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
B. 常温下,1LpH=11的NaOH溶液中由水电离出的H+的数目为10-11NA
C. 273K、101kPa下,22.4L由NO和O2组成的混合气体中所含分子总数为NA
D. 100g34%双氧水中含有H-O键的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图是用稻壳灰(SiO2:65%~70%、C:30%~35%)制取水玻璃的工艺流程:

下列说法正确的是( )
A. 原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值
B. 操作A与操作B完全相同
C. 该流程中硅元素的化合价发生改变
D. 反应器中发生的复分解反应为SiO2+2NaOH=Na2SiO3+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】I.现有以下物质:①NaCl固体;②液态CO2;③液态氯化氢;④汞;⑤固体BaSO4;⑥蔗糖;⑦酒精;⑧熔融的Na2CO3,请回答下列问题:
(1)以上物质中能导电的是____;
(2)以上物质属于电解质的是____;
(3)以上物质属于非电解质的是____;
(4)以上物质溶于水后形成的溶液能导电的是_____;
(5)属于盐的有____;
(6)写出⑧溶于水中的电离方程式____。
Ⅱ.在一定条件下,有下列物质:①8gCH4②6.02×1023个HCl分子③2molO2。按由小到大的顺序填写下列空白(填写序号):
(1)摩尔质量____;(2)物质的量_____;
(3)分子数目_____;(4)原子数目____;
(5)质量_____。
III.(1)分离胶体和溶液常用的方法叫____;
(2)等质量的O2和O3所含原子个数比为____;
(3)若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1mol·L-1的是
A.将80gSO3溶于水并配成1L的溶液
B.10gNaOH固体溶解在水中配成250mL溶液
C.将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50g水的溶液
D.标准状况下,将22.4L氯化氢气体溶于水配成1L溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应方程式如下:
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
请完成下列问题:
(1)在上述方程式中用双线桥法标注电子转移情况____________。
(2)浓盐酸在该反应中表现了____________(选填“氧化性”、“还原性”或“酸性”)。
(3)若15.8g KMnO4与足量的浓盐酸充分反应,则有______mol HCl被氧化,产生的Cl2在标准状况下的体积为__________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为Sb2S3,还含有PbS、As2S3、CuO、SiO2等)为原料制备金属锑的工艺流程如图所示:

已知:①浸出液中除含过量盐酸和SbCl5之外,还含有SbCl3、PbCl2、AsCl3、CuCl2等;
②常温下:Ksp(CuS)=1.27×10-36,Ksp(PbS)=9.04×10-29;
③溶液中离子浓度≤1.0×10-5mol·L-1时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有________ (填化学式)。
(2)“浸出”时,Sb2S3发生反应的化学方程式为___________________________________。
(3)“还原”时,被Sb还原的物质为________(填化学式)。
(4)常温下,“除铜、铅”时,Cu2+和Pb2+均沉淀完全,此时溶液中的c(S2-)不低于_____;所加Na2S也不宜过多,其原因为_________________________________。
(5)“除砷”时有H3PO3生成,该反应的化学方程式为________________________________。
(6)“电解”时,被氧化的Sb元素与被还原的Sb元素的质量之比为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-据此判断以下叙述错误的是
NH4++NH2-据此判断以下叙述错误的是
A. 液氨中含有NH3、NH4、NH2-三种微粒
B. 一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
C. 液氨的电离达到平衡c(NH3)= c(NH4+)=c(NH2-)
D. 只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D四种分子所含原子的数目依次为1、3、6、2,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D物质能刻蚀玻璃。
(1)A的分子式是________,写出A原子的价层电子排布式________。
(2)B分子的中心原子的杂化类型是________,分子空间构型是________,该分子属于________分子(填“极性”或“非极性”)。
(3)C的化学式是________,分子中含有的化学键类型是________。
(4)D物质的沸点比HCl的沸点高,其主要原因是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com