
科目: 来源: 题型:
【题目】常温下,将0.1 mol BaSO4粉末置于盛有500 mL蒸馏水的烧杯中,然后烧杯中加入Na2CO3固体(忽视溶液体积的变化)并充分搅拌,加入Na2CO3固体的过程中,溶液中几种离子的浓度变化曲线如图所示,下列说法中正确的是( )
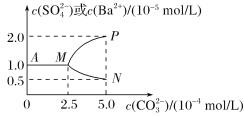
A. 相同温度时,Ksp(BaSO4)>Ksp(BaCO3)
B. BaSO4在水中的溶解度、Ksp均比在BaCl2溶液中的大
C. 反应BaSO4(s)+CO32- (aq) ![]() BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
BaCO3(s)+SO42- (aq),该反应的正反应平衡常数K1大于其逆反应的平衡常数K2
D. 若使0.1 mol BaSO4全部转化为BaCO3,至少要加入2.6 mol Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】80 ℃时,2 L 密闭容器中充入0.40 mol N2O4,发生反应N2O4![]() 2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
2NO2 ΔH=+Q kJ·mol-1(Q>0),获得如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
下列判断正确的是( )
A. 升高温度该反应的平衡常数K减小
B. 20~40 s 内,v(N2O4)=0.004 mol·L-1·s1
C. 反应达平衡时,吸收的热量为0.30 Q kJ
D. 100 s 时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
B. 空气吹出法是工业规模海水提溴的常用方法。其工艺的其中一个环节是把氯气通入酸化的浓缩海水(或苦卤)中。
C. 稀有气体(如氩)氛围中和加热条件下,可以用镁与TiCl4反应得到钛。
D. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,有c(HA)+c(A-)=0.1mol/L 的一组HA、KA 混合溶液,溶液中c(HA)、c(A-)与pH的关系如下图所示。下列叙述不正确的是

A. pH= 5.75 的溶液中: c(K+)>c(A- )>c(HA)>q(H+)>c(OH- )
B. 欲得W 点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1mol/L 且c(KA)
C. pH=3.75的溶液中:c(K+)+c(H+)-c(OH-)+c(HA)=0.1mol/L
D. 若A-的水解常数为Kb 则lgKb=-9.25
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)

(l)为探究温度对反应速率的影响,实验②中试剂A应为 ___。
(2)写出实验③中I一反应的离子方程式:____。
(3)对比实验②③④,可以得出的结论:____。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2。
ii. pH>9.28时,I2发生歧化反应:3I2+6OH-=IO3-+ 5I-+ 3H2O,pH越大,歧化速率越快。
(4)小组同学用4支试管在装有O2的储气瓶中进行实验,装置如图所示。

分析⑦和⑧中颜色无明显变化的原因:____。
(5)甲同学利用原电池原理设计实验证实pH=10的条件下确实可以发生I-被O2氧化为I2的反应,如右图所 示,请你填写试剂和实验现象_______________。

(深入探究)较高温度对反应速率的影响
小组同学分别在敞口试管和密闭试管中进行了实验⑨和⑩。

(6)对比实验⑨和⑩的现象差异,该小组同学经过讨论对实验⑨中的现象提出两种假设,请你补充假设1。
假设1:___。
假设2:45℃以上I2易升华,70℃水浴时,c(I2)太小难以显现黄色。
(7)针对假设2,有两种不同观点。你若认为假设2成立,请推测试管⑨中“冷却至室温后滴加淀粉出现蓝色”的可能原因(写出一条)。你若认为假设2不成立,请设计实验方案证明____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质结构、性质的说法中正确的是( )

①烃的密度比水的密度小
②C2H6、C4H10、C6H14在常温下均为气体
③1 mol苯最多与3 mol H2发生加成反应,是因为苯分子含有3个碳碳双键
④水芹烯(桂皮中的一种成分)键线式如图,其分子式为C10H16
⑤![]() 互为同系物
互为同系物
⑥甲烷与氯气在光照的条件下可以制取纯净的一氯甲烷
⑦C5H12有三种同分异构体
A. ①②⑤ B. ③④⑦ C. ③⑤⑥ D. ①④⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )

A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目: 来源: 题型:
【题目】人类向大气中排放的NOx对环境会产生危害,脱除NOx是科学家研究的重要课题。
(1) NOx对环境的一种危害是____。
(2) NH3还原法可将NOx还原为N2进行脱除。
已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H1=-1530kJ/mol
N2(g)+O2(g)=2NO(g)△H2=+180kJ/mol
写出NH3还原NO反应的热化学方程式:____。
(3)碱性KMnO4氧化法也可将NOx进行脱除。
①用KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整。____NO+____MnO4-+____=NO2-+3NO3-+__MnO42-+______
②下列叙述正确的是____(填字母序号)。
A.将脱除后的混合溶液进行分离可获得氮肥
B.反应后混合溶液中:c( MnO4-)+2c(MnO42-)=c(K+)
C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
③在实验室用KMnO4 ( NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224 L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO3-,理论上需要KMnO4的质量为____g(KMnO4摩尔质量为158 g·mol-l)。
(4)用Pl-g-C3N4光催化氧化法脱除NO的过程如下图所示。

①该脱除过程中,太阳能转化为 ___能。
②在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应:O2+2H++2e-=H2O2;Pl端的反应: ___;NO2最终转化为HNO3的化学方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com