
科目: 来源: 题型:
【题目】制取水煤气的反应为C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
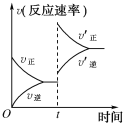
A.加压 B.升温 C.增大水蒸气浓度 D.增大碳的物质的量
查看答案和解析>>
科目: 来源: 题型:
【题目】关于某溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液生成白色沉淀,可确定有Cl-
B.加入BaCl2溶液生成白色沉淀,加稀盐酸沉淀不溶解,可确定有SO42-
C.某黄色溶液加CCl4,振荡、静置,下层溶液显紫红色,可确定有I2存在
D.加入稀盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,22.4LSO3含有NA个分子
B.1molNaHSO4溶于水后电离出的离子数目为2NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA
D.0.1mol·L-1的Ba(OH)2溶液中含有的OH-数目为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是
A.运用烤蓝技术,在钢铁表面形成一层致密的氧化物薄膜
B.古代有“曾青得铁则化为铜”是现代“湿法炼铜”的先驱,它利用了铁置换出铜的原理
C.FeCl3溶液可用于铜质线路板制作,利用了FeCl3能从含有Cu2+的溶液中置换出铜
D.常温下,铁遇浓硝酸发生钝化,所以可用铁质容器盛放浓硝酸
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同pH对Fe2+氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)
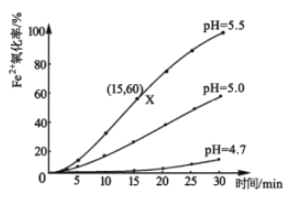
在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=______;增大溶液pH,Fe2+被氧化速率_______________(填增大”、“减小”或“无影响”)。
(2)在pH=13的环境下,Fe2+的氧化变质可以理解为:第一步:Fe2++2OH—=Fe(OH)2,第二步__________________________(用化学方程式回答)当氧化达到平衡时,c( Fe2+) /c(Fe3+)__________4.0×1022(填“>”“<”或“=”)。已知Ksp[Fe(OH)3]=2.5×10—39, Ksp[Fe(OH)2]=1.0×10—15
(3)工业上可用H2还原法处理NO,反应原理为:2NO(g)+2H2(g) ==N2(g)+2H2O(g): △H=a已知在标准状况,由元素最稳定的单质生成1mol纯化合物时的焓变叫标准摩尔生成焓。NO(g)和H2O(g)的标准摩尔生成焓分别为+90kJ/mol、-280 kJ/mol,则a=_______。
(4)已知2NO(g)+O2(g)![]() 2NO(g) △H= —110 kJ·mol—1;25℃时,将NO和O2按物质的量之比为2:1充入刚性反应容器中用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
2NO(g) △H= —110 kJ·mol—1;25℃时,将NO和O2按物质的量之比为2:1充入刚性反应容器中用测压法研究其反应的进行情况。体系的总压强p随时间t的变化如下表所示(忽略NO2与N2O4的转化)
t/min | 0 | 80 | 160 | ∞ |
p/kpa | 75.0 | 63.0 | 55.0 | 55.0 |
0~80min,v(O2)=_______kpa/min。用压强代替浓度所得到的平衡常数用K(p)表示,25℃时,K(p)的值为___________(保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学弄清氨的喷泉实验原理后有了一个创新的设计:如果改换一下烧瓶内的气体和胶头滴管与烧杯中的液体,也能做成喷泉实验。下列各组中的气体和液体不符合该同学设计的是
A.HCl和水B.NO2和NaOH溶液
C.Cl2和NaOH溶液D.O2和水
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置或实验操作正确的是

A. ①用pH试纸测某溶液的酸碱性 B. ②探究氧化性:KMnO4>Cl2>I2
C. ③吸收氨气制氨水 D. ④中和滴定实验
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是礦胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。乙耽苯胺的制备原理为:

实验参数:
名称 | 相对分子质量 | 性状 | 密度g/cm3 | 沸点/。C | 溶解度 | |
苯胺 | 93 | 无色油状液体,具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
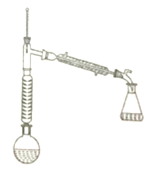
实验步骤:
步骤1:在圆底烧瓶中加入无水苯胺9.30mL,冰醋酸15.4mL,锌粉0.100g,安装仪器,加入沸石,调节加热温度,使分馏柱顶温度控制。在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出。
步骤2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却,结晶,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步骤3:将此粗乙酰苯胺进行重结晶,晾干,称重,计算产率。
(1)步骤1中所选圆底烧瓶的最佳规格是________。
a. 25ml b. 50ml c. 150ml d. 200ml
(2)实验中加入少量锌粉的目的是_________________________________。
(3)步骤1加热可用____________(填“水浴”、“油浴”或“直接加热”):从化学平衡的角度分析,控制分馏柱上端的温度在105℃左右的原因___________________。
(4)洗涤乙酰苯胺粗品最合适的方法是_______(填序号)。
a.用少量冷水洗 b.用少量热水洗 c.用酒精洗
(5)乙酰苯胺粗品因含杂质而显色,欲用重结品进行提纯,步骤如下
a.蒸发结晶 b.冷却结晶 c.趁热过滤 d.加入活性炭
(6)该实验最终得到纯品9.18g,则乙酰苯胺的产率是_____________%(结果保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示与对应叙述相符的是
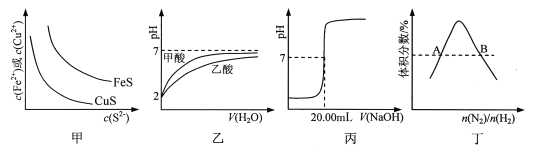
A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】运用中和反应反应热的测定方法,即保温、隔热条件下,向盛有20mL2.08mol/L的NaOH溶液的试管中分五次共加入5 mL未知浓度的H2SO4溶液(边加边振荡,每次加入1 mL)后,测得溶液的温度分别是21.4℃、22.5℃、24.2℃、25.2℃、25.18℃,则该硫酸溶液的物质的量浓度约是( )
A. 20.8 mol/L B. 5.2 mol/L C. 6.9 mol/L D. 4.16 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com